
【题目】某元素的原子核外有3个电子层,最外层有4个电子,则该原子核内的质子数为( )
A.14B.15C.16D.17
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Mg2+、Na+、SO42﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Na+、K+、OH﹣、Cl﹣
D.Ba2+、CO32﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)![]() xC(g),若经2s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6mol/L。现有下列几种说法:①2s内用物质A表示的平均反应速率为0.3 mol/(L·s);②2s内用物质B表示的平均反应速率为0.6 mol/(L·s);③2s时物质B的转化率为70%;④x=2。其中正确的是( )
xC(g),若经2s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6mol/L。现有下列几种说法:①2s内用物质A表示的平均反应速率为0.3 mol/(L·s);②2s内用物质B表示的平均反应速率为0.6 mol/(L·s);③2s时物质B的转化率为70%;④x=2。其中正确的是( )
A. ①③ B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,取出少量滴入氯化钡溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量过氧化钠,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入过氧化钠的量关系如图所示,则①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-中一定存在的离子是

A. ③④⑧ B. ③④⑦ C. ②③④⑧ D. ①③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。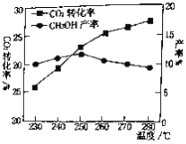
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)![]() CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K | 398 | 498 | … |
平衡常数/K | 126.5 | K1 | … |
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是

①分子式为C10H18O3
②易溶于水
③分子中含有两种官能团
④可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
⑤能发生加成、取代、酯化、消去、催化氧化等反应
⑥所有的原子可能共平面
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.Na2O,Na2O2 , FeO,Fe2O3都是碱性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.纯碱、烧碱、四氯化碳均为电解质
D.水玻璃、氯水、漂白粉均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com