
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
【答案】 2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol 2 < < 0.6mol/(L·min) 80% > 其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小
【解析】(1)①2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1 ,②O2(g)![]() O2(aq) △H =n kJ·mol-1,根据盖斯定律,将①+②得:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol,故答案为:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol;
O2(aq) △H =n kJ·mol-1,根据盖斯定律,将①+②得:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol,故答案为:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol;
(2)①当溶解氧浓度为4.0mgL-1时,c(Na2SO3)与速率数值关系如表,v1:v2=c1a(SO32-):c2a(SO32-), ![]() =
=![]() ,解得a=2;故答案为:2;
,解得a=2;故答案为:2;
②ln![]() =
=![]() (
(![]() -
-![]() )随着Ea的增大而增大,富氧区的ln
)随着Ea的增大而增大,富氧区的ln![]() 较小,故Ea(富氧区)<Ea(贫氧区);故答案为:<;
较小,故Ea(富氧区)<Ea(贫氧区);故答案为:<;
(3) 等物质的量的Na2SO3和Na2SO4混合溶液中,Na2SO3属于强碱弱酸盐,水解显碱性,根据物料守恒,c(SO32-)+c(HSO3-)+ c(H2SO3)= c(SO42-),则c(SO32-)+c(HSO3-)<c(SO42-),故答案为:<;
(4)①0到0.5min时:
5CO(g)+I2O5(s)5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)= ![]() =0.30,得x=0.6mol,则从反应开始至a点时的反应速率为v(CO)=
=0.30,得x=0.6mol,则从反应开始至a点时的反应速率为v(CO)= 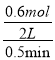 =0.6molL-1min-1,故答案为:0.6molL-1min-1;
=0.6molL-1min-1,故答案为:0.6molL-1min-1;
② 5CO(g)+I2O5(s)5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol y y
b点量/mol 2-y y
根据a点时CO2的体积分数φ(CO2)= ![]() =0.80,得y=1.6mol,转化率等于=
=0.80,得y=1.6mol,转化率等于=![]() ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
③其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小,则化学平衡常数:Kb>Kd,故答案为:>;其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小。


科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:

(1)操作Ⅰ的名称为_________,所需要的玻璃仪器有_________、玻璃棒、烧杯;
(2)加入试剂C的目的是将Cu2+全部转化为Cu,以便回收铜单质,发生的离子方程式为__________________________________;
(3)操作Ⅲ为加热浓缩、__________、过滤、洗涤、干燥;
(4)由于硫酸亚铁溶液露置于空气中容易变质,请设计一个简单的实验方案验证硫酸亚铁是否变质?(请写出必要的实验步骤、现象和结论)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物的化学式为[Cr(CH3COO)2]2·2H2O,该水合物通常为红棕色晶体,是一种常用的氧气吸收剂,不溶于水和乙醚(一种易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,易被氧化。已知Cr3+水溶液呈绿色,Cr2+水溶液呈蓝色。实验室制备醋酸亚铬水合物的装置如下图所示。

(1)检查装置气密性后,向左侧三颈烧瓶中依次加入过量锌粒和适量CrCl3溶液,关闭K1打开K2,旋开a的旋塞,控制好滴速。a的名称是___________,此时左侧三颈烧瓶中发生反应的化学方程式为_______、________。一段时间后,整个装置内充满氢气,将空气排出。当观察到左侧三颈烧瓶中溶液颜色由绿色完全转变为蓝色时,关闭K2,打开K1,将左侧三颈烧瓶内生成的CrCl2溶液压入右侧三颈烧瓶中,则右侧三颈烧瓶中发生反应的离子方程式为________________________________________。
(2)本实验中所有配制溶液的水均需煮沸,其原因是______________________。右侧的烧怀内盛有水,其中水的作用是_______________________________________________。
(3)当观察到右侧三颈烧瓶内出现大量红棕色晶体时,关闭a 的旋塞。将红棕色晶体快速过滤、水洗、乙醚洗、干燥,即得到[Cr(CH3COO)2]2·2H2O。其中用乙醚洗涤产物的目的是_______________________。
(4)称量得到的[Cr(CH3COO)2]2·2H2O晶体,质量为m g,,若所取用的CrCl3溶液中含溶质n g,则[Cr(CH3COO)2]2·2H2O(M1=376 )的产率是______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是你,化学是我,化学深入我们生活。下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.为了身体健康,不食用任何使用食品添加剂的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是优秀的水处理剂,具有很强的氧化性,氧化能力优于氯气和臭氧,溶于水中能有效杀灭水中的微生物和藻类,还能氧化分解各种有机、无机污染物,如酚、有机氮、硫化物、氰化物等,而且在整个净化过程中不会产生三氯甲烷、氯代酚等二次污染物。工业上常用次氯酸钠氧化法和电解法先制得高铁酸钠后再与氢氧化钾饱和溶液反应制备高铁酸钾。
I.电解法采用氢氧化钠作电解质溶液,铁丝网和石墨作电极材料,先制得高铁酸钠,请判断铁丝网作_______极, 阴极产生气体是__________。
II.次氯酸钠氧化法制备高铁酸钾简要流程如下:

(1)写出在碱性条件下过程①反应的离子方程式:___________________________________。
(2)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因:______________________________________。
(3)K2FeO4溶于水后,会慢慢放出气体,并杀菌消毒,净化水中悬浮杂质,写出它和水反应的离子方程式_______________________________________________________。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___________(填序号)。
A.H2O B.稀KOH溶液、异丙醇
C.KCl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(4)K2FeO4溶于水后,会水解生成如下图中的物种,纵坐标表示其分布分数,则下列说法不正确的是________________。
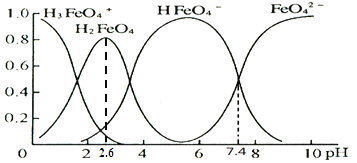
A.FeO42+H2OHFeO4+OH的平衡常数为107.4
B.从pH=1到pH=2.6,H2FeO4的分布分数逐渐增大
C.向pH=6的该溶液中加KOH溶液,反应的离子方程式为HFeO4+ OH = FeO42+H2O
D.根据图中信息,铁元素有4种存在形态,它们总是可以同时大量存在
(5)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42+CrO2 +2H2O=CrO42+Fe(OH)3↓+OH
②2CrO42+2H+=Cr2O72+H2O
③Cr2O72+6Fe2++14H+=2Cr3++6Fe3+ +7H2O
现称取1.980g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为21.90 mL。则上述样品中高铁酸钾的质量分数为______________。(保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com