
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
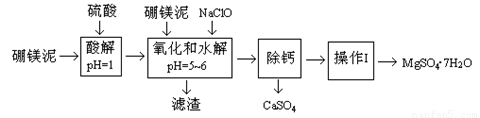
根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施__________、______________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是 。在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作 。
(5)已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤 、 。
(6)现有l.60 t硼镁泥,生产MgSO4·7H2O,若生产过程的产率为50%,则能生产出MgSO4·7H2O产品 t (计算结果保留三位有效数字)。(H:1 O:16 Mg:24 S:32)
(1)升温、把硼镁泥粉碎、搅拌等(2分) (2)SiO2(2分)
(3)Mn2+ + ClO- + H2O == MnO2↓ + 2H+ + Cl-(2分) 2Fe2+ + ClO- + 2H+ == 2Fe3+ + Cl- + H2O(2分)
(4)取少量滤液于试管中,向其中几滴硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。 (3分)
(5)蒸发浓缩(结晶),趁热过滤 (2分) (6)1.97 (3分)
【解析】
试题分析:(1)此处主要考查反应速率的影响因素,所以要想加快酸溶解速率可以从外因浓度、温度、接触面积等考虑,所以答案可以是升温、把硼镁泥粉碎、搅拌等。
(2)由于该硼镁泥的成分有MgO、CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等物质,所以酸溶后生成的阳离子有Mg2+、Ca2+、Mn2+、Fe3+、Fe2+、Al3+ ,不溶的有SiO2,加入氧化物NaClO后Fe2+ 被氧化为Fe3+,Mn2+ 被氧化为MnO2 ,所以调节pH至5—6,阳离子发生沉淀,生成的沉淀有Fe(OH)3、Al(OH)3,所以滤渣的所有成分为Fe(OH)3、Al(OH)3、MnO2、SiO2 。
(3)加入氧化剂NaClO,Mn2+、Fe2+均能够被其氧化,发生氧化还原反应,根据所给的产物形式,根据氧化还原反应缺项配平法,先把发生化合价变化的离子和物质写出,然后再根据电子得失守恒配平,再用电荷守恒和原子守恒配平所缺物质。所以离子方程式为:Mn2+ + ClO- + H2O == MnO2↓ + 2H+ + Cl-(2分) 2Fe2+ + ClO- + 2H+ == 2Fe3+ + Cl- + H2O。
(4)检验Fe3+ 的方法是加入KSCN,利用显色反应检验,所以可以向溶液中加入硫氰化钾溶液检验溶液中是否存在三价铁离子,方法为:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
(5)由温度对硫酸镁、硫酸钙的溶解度影响可看出,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到了MgSO4•7H2O,故答案为:蒸发浓缩,趁热过滤;过滤(或过滤洗涤);
(6)100g硼镁泥中氧化镁的物质的量为:1.6×106g×40%×50%÷40g/mol=8×103mol,根据镁原子守恒,生成MgSO4•7H2O的物质的量为8×103mol,质量为246g/mol×8×103mol=1.968×106g≈1.97t,MgSO4•7H2O的质量为1.97t。
考点:本题考查的是化工流程类的推断,涉及反应速率、氧化还原反应、离子检验、离子沉淀、实验基本操作、计算等知识,考查范围广、综合性强。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:

| 温度(°C) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.197 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源:2013届江苏省扬州中学高三12月质量检测化学试卷(带解析) 题型:填空题
(14分)硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源:2012届上海市松江区高三上学期期末(1月)考试化学试卷(带解析) 题型:填空题
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市松江区高三上学期期末(1月)考试化学试卷(解析版) 题型:填空题
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10 mL B.20 mL C.50 mL D.100 mL
2.加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
3.滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 。
4.在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 。
5.已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
6.实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com