��һ�����º����£���2mol A�����2mol B����ͨ�����Ϊ2L���ܱ������з������·�Ӧ��2A��g��+B��g��?x C��g��+2D��s����2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2mol B�������C��Ũ��Ϊ1.2mol?L
-1��
��1���ӿ�ʼ��Ӧ���ﵽƽ��״̬������C��ƽ����Ӧ����Ϊ
0.6mol/��L?min��
0.6mol/��L?min��
��
��2��x=
3
3
��
��3��A��ת������B��ת����֮��Ϊ
2��1
2��1
��
��4�����и������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����
B
B
��
A��ѹǿ���ٱ仯 B�������ܶȲ��ٱ仯
C��A������������B����������֮��Ϊ2��1
��������Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ�Ϻϳɼ״��ķ�Ӧԭ��Ϊ��CO��g��+2H
2��g��?CH
3OH��g����H��
�±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� |
250�� |
300�� |
350�� |
| K |
2.041 |
0.270 |
0.012 |
�ٸ��ݱ������ݿ��жϡ�H
��
��
0 �����������=����������
����300��ʱ����2mol CO��3mol H
2��2mol CH
3OH�����ݻ�Ϊ1L���ܱ������У���ʱ��Ӧ��
A
A
��
A�����������ƶ� B�����淽���ƶ� C������ƽ��״̬ D�����ж�
��2����֪�ڳ��³�ѹ�£�
��2CH
3OH��l��+3O
2��g���T2CO
2��g��+4H
2O��l����H=-1451.6kJ?mol
-1��2CO��g��+O
2��g���T2CO
2��g����H=-566.0kJ?mol
-1д���������¼״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
CH3OH��l��+O2��g���TCO��g��+2H2O��l����H=-442.8kJ/mol
CH3OH��l��+O2��g���TCO��g��+2H2O��l����H=-442.8kJ/mol
��
��3���Լ״�������Ϊԭ�ϣ�KOH��Һ��Ϊ����ʹ���ȼ�ϵ���ܷ�ӦΪ��2CH
3OH+3O
2+4KOH�T2K
2CO
3+6H
2O���������ĵ缫��ӦʽΪ
O2+2H2O+4e-�T4OH-
O2+2H2O+4e-�T4OH-
�����ŷ�Ӧ�IJ��Ͻ�����Һ��pH
��С
��С
���������С�����䡱����
��4������Ը�ȼ�ϵ��Ϊ��Դ��ʯī��������ⱥ��ʳ��ˮ����õ������������ĵ缫��ӦʽΪ
2Cl--2e-�TCl2��
2Cl--2e-�TCl2��
��


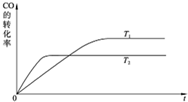 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�

 ��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ���� ��2012?������һģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��2012?������һģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����