
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
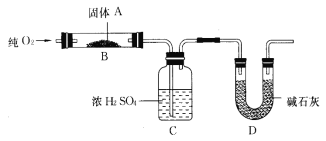
取17.1 g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是_______________________________;
(2) D装置的作用是______________________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________________;
(3)通过该实验,能否确定A中是否含有氧元素,其理由?_____________________________ ;
(4)若A的摩尔质量为342 g/mol,C装置增重9.9 g,D装置增重26.4 g,则A的分子式为______________________________;
(5)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_______________________________。
【答案】使有机物A充分燃烧吸收A燃烧后生成的CO2D装置中的碱石灰可以吸收空气中的水和二氧化碳,对生成的二氧化碳质量测定有干扰能确定;如果碳元素的质量和氢元素的质量小于17.1g,则有氧元素C12H22O11C12H22O11(蔗糖)+H2O ![]() C6H12O6(葡萄糖)+C6H12O6(果糖)
C6H12O6(葡萄糖)+C6H12O6(果糖)
【解析】
(1)燃烧法测定某固体有机物A的分子组成,要通入过量O2使有机物在氧气中充分燃烧生成二氧化碳和水;故答案为:使有机物A充分燃烧;
(2)C装置中的试剂为浓硫酸,用于吸收有机物燃烧生成的水,D装置中的试剂是碱石灰用于吸收有机物燃烧生成的二氧化碳;D装置中的碱石灰可以吸收空气中的水和二氧化碳,对生成的二氧化碳质量测定有干扰,因此该套装置需要改进,故答案为:吸收A燃烧后生成的CO2;D装置中的碱石灰可以吸收空气中的水和二氧化碳,对生成的二氧化碳质量测定有干扰;
(3)通过浓硫酸增重的质量可以求出有机物中氢的质量,通过碱石灰增重的质量可以求出有机物中碳的质量,再根据A的质量判断是否有氧元素;故答案为:能确定,如果碳元素的质量和氢元素的质量小于17.1g,则有氧元素;
(4)浓硫酸增重可知水的质量为9.9g,可计算出n(H2O)=![]() =0.55mol,n(H)=1.1mol,m(H)=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=
=0.55mol,n(H)=1.1mol,m(H)=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=![]() =0.6mol,m(C)=7.2g,m(C)+m(H)=8.31g,有机物的质量为17.1g,所以有机物中氧的质量为8.79g,n(O)=
=0.6mol,m(C)=7.2g,m(C)+m(H)=8.31g,有机物的质量为17.1g,所以有机物中氧的质量为8.79g,n(O)=![]() =0.55mol,n(C):n(H):n(O)=0.6mol:1.1mol:0.55mol=12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11,故答案为:C12H22O11;
=0.55mol,n(C):n(H):n(O)=0.6mol:1.1mol:0.55mol=12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11,故答案为:C12H22O11;
(5)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖,其在催化剂作用下水解的化学方程式为C12H22O11(蔗糖)+H2O ![]() C6H12O6(葡萄糖)+C6H12O6(果糖);故答案为:C12H22O11(蔗糖)+H2O
C6H12O6(葡萄糖)+C6H12O6(果糖);故答案为:C12H22O11(蔗糖)+H2O ![]() C6H12O6(葡萄糖)+C6H12O6(果糖)。
C6H12O6(葡萄糖)+C6H12O6(果糖)。


科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
B.从海水中可以得到NaCl,电解熔融NaCl可制备Na
C.海水蒸发制海盐的过程中只发生了化学变化
D.目前工业上直接由海水提取I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质的量是描述微观离子集合的一个物理量
B.摩尔可以把物质的量、体积等宏观量与原子、分子或离子等微观离子联系起来
C.阿伏加德罗常数可近似表示为6.02×1023
D.摩尔是国际单位制的七个基本物理量之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:

已知:在质谱图中烃A的最大质荷比为118,其苯环上的一氯代物共三种,核磁共振氢谱显
示峰面积比为3:2:2:2:1。
根据以上信息回答下列问题:
(1)A的官能团名称为__________________,B→C的反应条件为_____________,E→F的反应类型为_____________。
(2)I的结构简式为____________________,若K分子中含有三个六元环状结构,则其分子式为________________。
(3)D与新制氢氧化铜悬浊液反应的离子方程式为_______________________________。
(4)H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式___________________________________。
(5)J是一种高分子化合物,则由C生成J的化学方程式为
______________________________________________________________________。
(6)![]() 已知:
已知:![]() (R为烃基)
(R为烃基)
设计以苯和乙烯为起始原料制备H的合成路线(无机试剂任选)。
[合成路线示例:]![]()
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤干馏是充分利用煤资源的方法之一。将煤焦油分离后得到甲苯,通过如图所示多步反应得C。
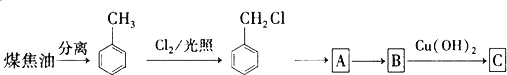
下列说法正确的是
A. 可以采用酸性高锰酸钾溶液区别甲苯和A
B. 甲苯与C都能发生还原反应
C. 甲苯在30℃时苯环上的H原子被硝基取代,只能得到间硝基甲苯
D. 有机物A既能发生酯化生反应,又能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氧、氯、镁、镍、铜是几种重要的元素,请回答下列问题:
(1)镍元素的核电荷数为28,则基态原子的电子排布式为____________________,结构中有__________种不同形状的电子云。
(2)MgO的熔点高于CuO的理由是________________________________________。
(3)镁原子第一电离能反常地高于铝的原因是_____________________________。
(4)Ni与CO能形成配合物![]() ,该分子中
,该分子中![]() 键与
键与![]() 键个数比为__________。
键个数比为__________。
(5) ![]() 分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
(6)铜与氧可形成如图所示的晶胞结构,其中铜原子均匀地分散在晶胞内部,a、b原子的坐标参数依次为(0,0,0)、![]() ,则d原子的坐标参数为____________________,已知:该晶体的密度为
,则d原子的坐标参数为____________________,已知:该晶体的密度为![]() ,
, ![]() 是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。
是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g) △H<0。反应过程中测定的数据如下表:
2Z(g) △H<0。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请计算:
(1)反应前2 min的平均速率ν(Z) = __________________________,
(2)到达平衡时,X的转化率为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com