
【题目】有如下反应:
①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | ②H++OH-=H2O |
③2Fe+3Cl2 | ④NaHCO3+NaOH=Na2CO3+H2O |
⑤CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 | ⑥NaClO+CO2+H2O=HClO+NaHCO3 |
⑦2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | ⑧CO2+H2O=H2CO3 |
请回答:
(1)上述反应中有电子转移的是___(填序号),因此该类反应属于__反应。
(2)反应⑤的离子方程式是__。
(3)上述反应中属于复分解反应的是__(填序号)。复分解反应发生的条件是i.生成沉淀,ii.放出气体,iii.生成水等难电离物质,若要由反应印证i、ii、iii,则除了这几个反应外,请补充反应:_(写一个符合条件的化学方程式或离子方程式)。
(4)由反应①及所学知识判断:在该反应发生的条件下,NO3-、H+、Cu2+的氧化性由大到小的顺序是___。
【答案】①③⑦ 氧化还原 Cu2++2OH-=Cu(OH)2↓ ②④⑤⑥ 2H++CO32-=CO2↑+H2O NO3->Cu2+>H+
【解析】
(1)化学反应中有化合价发生变化的反应是氧化还原反应,其实质为存在电子的转移。反应①③⑦是氧化还原反应,反应②④⑤⑥⑧是非氧化还原反应,所以上述反应中有电子转移的是①③⑦,故答案为:①③⑦;氧化还原。
(2)反应⑤是CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,离子反应方程式为:Cu2++2OH-=Cu(OH)2↓;
(3)复分解反应是指两种盐溶液反应生成另外两种盐溶液的反应,上述反应中属于复分解反应的是②④⑤⑥,复分解反应发生的条件是i.生成沉淀,ii.放出气体,iii.生成水等难电离物质,若要由反应印证i、ii、iii,则除了这几个反应外,补充生成气体的复分解反应,其反应的离子反应方程式为:2H++CO32-=CO2↑+H2O,故答案为:②④⑤⑥;2H++CO32-=CO2↑+H2O;
(4)反应①为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu的化合价由0价升高为+2价,发生氧化反应,Cu(NO3)2为氧化产物,Cu作还原剂,具有还原性,N元素化合价由+5价降低为+2价,发生还原反应,NO 为还原产物,HNO3作氧化剂,具有氧化性,氧化剂的氧化性强于氧化产物,所以NO3-、H+、Cu2+的氧化性由大到小的顺序是:NO3->Cu2+>H+,故答案为:NO3->Cu2+>H+。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】科学家对CO2的应用研究日新月异。
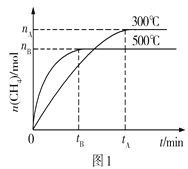
(1)科学家研制成功一种新型催化剂,能将CO2转变为甲烷。在常压、300℃,CO2与H2体积比为1︰4时在体积为V L的容器中反应,CO2转化率达90%。由图1可知升高温度,K将___(填“增大”“减小”或“不变”);300℃时,从反应开始,到达到平衡,以H2的浓度变化表示化学反应速率是____(用nA、tA、V表示)。
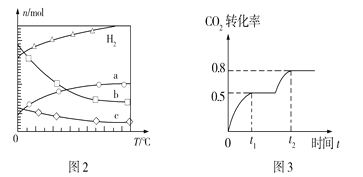
(2)CO2经催化加氢还可合成低碳烯烃有机物:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=Q kJ·mol1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
C2H4(g)+4H2O(g) ΔH=Q kJ·mol1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
①Q___0(填“>”“=”或“<”);
②曲线c表示的物质为____;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是___。
(3)已知CO2(g)+2CH3OH(g)![]() CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为_____mL。
CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.常温下,![]() 的氢氧化钠溶液中加入10mL
的氢氧化钠溶液中加入10mL ![]() 的HA,所得溶液
的HA,所得溶液![]()
B.![]() 时,
时,![]() 与
与![]() 的氯化铵溶液的pH前者大
的氯化铵溶液的pH前者大
C.室温时浓度均为![]() 的
的![]() 和
和![]() 的混合液,pH为10,则
的混合液,pH为10,则![]()
D.![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液有许多奇妙之处,你只有深入的去思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )
A.浓度相同的![]() 、
、![]() 两种盐溶液中,所有阴离子总浓度后者大
两种盐溶液中,所有阴离子总浓度后者大
B.常温下,1![]() 的
的![]() 溶液与1
溶液与1![]() 的NaOH溶液混合后,所得混合液中:
的NaOH溶液混合后,所得混合液中:![]()
C.物质的量浓度相同的![]() 和
和![]() 两种溶液中,
两种溶液中,![]() 前者小于后者
前者小于后者
D.常温下,某溶液中由水电离出的![]() ,则此溶液可能是盐酸
,则此溶液可能是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素①—⑥的位置回答下列问题:
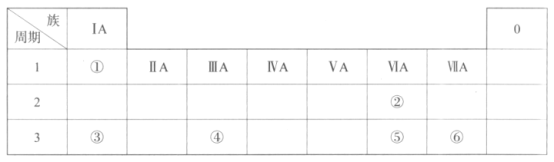
(1)元素①的一种核素中,含有1个质子和1个中子,表示该核素组成的符号是__。
(2)⑤的原子结构示意图是__。
(3)上述元素中,原子半径最大的是__(写元素符号)。
(4)仅由①、⑥组成的化合物的电子式为__,该化合物的分子中含有__(填“极性”或“非极性”)共价键。
(5)金属性:③__④(填“>”或“<”),列举一条能证明该结论的实验事实:__。
(6)下列说法正确的是__(填序号)。
a.②、③组成的化合物只有一种
b.②的气态氢化物稳定性高于⑤
c.⑥在化合物中呈现的最高化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有![]() 以及
以及![]() 有机硫
有机硫![]() ,煤气燃烧后含硫杂质会转化成
,煤气燃烧后含硫杂质会转化成![]() 从而引起大气污染,因此煤气中
从而引起大气污染,因此煤气中![]() 的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
![]() 在水溶液中的电离方程式为______。
在水溶液中的电离方程式为______。![]() 只写第一级
只写第一级![]()
![]() 脱除煤气中COS的方法有
脱除煤气中COS的方法有![]() 的KOH溶液氧化法、
的KOH溶液氧化法、![]() 还原法、水解法等。
还原法、水解法等。
![]() 的分子结构与
的分子结构与![]() 相似,COS的结构式为______。
相似,COS的结构式为______。
![]() 的KOH溶液将COS氧化为硫酸盐的离子方程式为______。
的KOH溶液将COS氧化为硫酸盐的离子方程式为______。
![]() 已知:
已知:![]() 、COS、
、COS、![]() 、CO的燃烧热依次为
、CO的燃烧热依次为![]() 、
、![]() 、
、![]() 、
、![]() ;
;![]() 还原COS发生的反应为
还原COS发生的反应为![]() ,该反应的
,该反应的![]() ______
______![]() 。
。
![]() 用活性
用活性![]() 催化COS水解反应为
催化COS水解反应为![]() ,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率
,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率![]() 未达到平衡
未达到平衡![]() 如图1所示;某温度下,COS的平衡转化率与
如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。
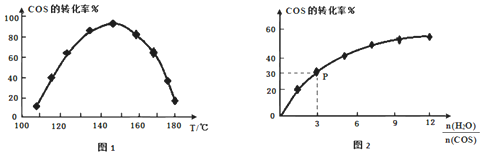
由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是______。由图2可知,P点时平衡常数![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下浓度均为![]() 的下列五种溶液:
的下列五种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。
这5种溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是______,
中各离子浓度由大到小的顺序是______,![]() 的水解平衡常数
的水解平衡常数![]() ______。
______。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时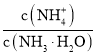 的值______
的值______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是______
的溶液分别蒸干并灼烧,最终可得原溶质的是______![]() 填序号
填序号![]() 。
。
![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物: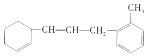 。
。
(1)该物质苯环上的一氯代物有___种。
(2)1mol该物质和足量溴水混合,消耗Br2的物质的量为___mol。
(3)下列说法不正确的是___(填序号)。
A.该有机物可发生加成、取代、氯化等反应
B.该有机物和甲苯属于同系物
C.该有机物使溴水褪色的原理与乙烯相同
D.该有机物能使酸性KMnO4溶液褪色,发生的是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是( )

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能用于做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2和N2O4的混合气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com