
【题目】大雁体内的主要能源物质和储能物质分别是( )
A.糖类和脂肪B.脂肪和蛋白质C.脂肪和糖元D.脂肪和脂肪
科目:高中化学 来源: 题型:
【题目】下列物质的用途不正确的是( )
A. 水玻璃可用作木材防火剂 B. 用大量的二氧化硫作食品漂白剂
C. 硅可用于制造太阳能电池 D. 食醋可作食品酸味剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是
①N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g)===2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g)===![]() N2(g)+
N2(g)+![]() H2(g) ΔH=+46.2 kJ/mol
H2(g) ΔH=+46.2 kJ/mol
④2NH3(g)===N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A. ①③ B. ②④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.髙锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是_______________________________(用化学方程式表示)。
(2)第④步通人适量CO2,发生反应生成MnO4-、MnO2和碳酸盐,则发生反应的离子方程式为_______________________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_________________(用化学方程式表)。
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性髙锰酸钾溶液,则酸性髙锰酸钾溶液会褪色,写出该反应的离子方程式: ________________________________。
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。

(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同______(填“相同”或“不相同”)。
(6)若装置B中装有5.0 mL 1.0 mol L-1的碘水,当通入足量Cl2完全反应后,共转移了5. 0×10-2 mol电子,则该反应的化学方程式为____________________________。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4 : 3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加人氯化钡溶液,有白色沉淀产生。 写出Cl2与含有X的溶液反应的离子方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是
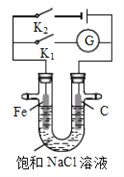
A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

试回答:
①实验1、2研究的是__________________________对H2O2分解速率的影响。
②实验2、3的目的是_______________________________________________。
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________________________。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是__________________________________。
(3)实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____________________的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(气)+ 3Y2(气)![]() 2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
①各物质的浓度有可能的是___________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a、b的取值必须满足的一般条件是_______________________.
③a的取值范围是:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1NaOH溶液的体积为( )
A. 40 mL B. 72 mL
C. 80 mL D. 128 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是
①增大压强 ②增加炭的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升温
A. ①③④ B. ①③⑥ C. ②④⑥ D. ③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com