
| 1000ρw |
| M |
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
| 0.8mol×(6-4) |
| 2 |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、HCO3- |
| B、Cu2+、Ba2+、NO3-、SO42- |
| C、Na+、K+、Cl-、NO3- |
| D、Fe3+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应速率增大,逆反应速率减小,平衡一定向正反应方向移动 |
| B、正反应速率减小,逆反应速率减小,平衡一定向逆反应方向移动 |
| C、若同时扩大容器体积,则正逆反应速率一定都减小,平衡向逆反应方向移动 |
| D、若温度降低至氨气液化,则平衡一定向正反应方向移动,氨气产率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
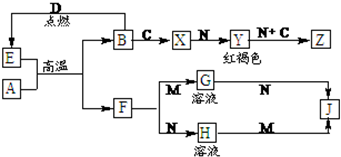
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与氧气反应时,产物是由O2的用量决定的 |
| B、铝箔在空气中受热可以熔化且会发生剧烈燃烧 |
| C、金属与非金属发生反应时,被氧化的一定是金属 |
| D、铁丝不论在空气中还是纯氧中都不会燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com