
【题目】在1L含0.2molKOH、0.1molNaAlO2和0.1 mol Ba(NO3) 2 的混合溶液中,逐滴加入浓度为0.1 mol/L 的H 2 SO 4 溶液,下列图像中能表示反应产生的沉淀的物质的量和所加入硫酸溶液的体积关系是(已知AlO2-和Ba2+可以大量共存)

【答案】A
【解析】
试题分析:在1L含0.2molKOH、0.1molNaAlO2和0.1 mol Ba(NO3) 2 的混合溶液中,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变。第一阶段:由发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,Ba(OH)2反应完毕,需加入0.1molH2SO4,H2SO4溶液的体积为0.1mol÷0.1L=1L,生成沉淀n(BaSO4)=0.1mol;第二阶段:由发生反应AlO2-+H++H2O=Al(OH)3↓可知,0.1molAlO2-反应完毕,该阶段需加入0.05molH2SO4,H2SO4溶液的体积为0.05mol÷0.1mol/L=0.5L,该阶段生成沉淀n[Al(OH)3]=0.1mol,但加入相同体积的硫酸,该阶段比第一阶段生成沉淀的多,为第一阶段的2倍;第三阶段:由发生反应Al(OH)3+3H+=Al3++3H2O可知,沉淀减少,0.1molAl(OH)3完全溶解,该阶段需加入(0.1mol8×3)÷2=0.15molH2SO4,H2SO4溶液的体积为0.15mol÷0.1L=1.5L,沉淀n(BaSO4)=0.1mol。由上述分析可知:第一阶段产生沉淀n(BaSO4)=0.1mol,加入H2SO4溶液的体积为1L;第二阶段又生成沉淀n[Al(OH)3]=0.1mol,此时沉淀总量为0.2mol,该阶段加入H2SO4溶液的体积为0.1L,此时加入H2SO4溶液的总体积为1.5L;第三阶段0.1molAl(OH)3完全溶解,此时沉淀n(BaSO4)=0.1mol,该阶段加入H2SO4溶液的体积为1.5L,此时加入H2SO4的总体积为3L,故沉淀的量与H2SO4溶液体积关系图为:
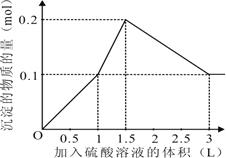 ,答案选A。
,答案选A。


科目:高中化学 来源: 题型:
【题目】食品卫生与身体健康密切相关,下列做法中对人体健康不会造成危害的是
A. 在沥青公路上翻晒粮食 B. 肉类食品用福尔马林保鲜
C. 竹笋用二氧化硫气体漂白 D. 用小苏打做发酵粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为______________________。
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+NiOOH![]() 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH_____________(填“增大”“减小”或“不变”),该电极的电极反应_________。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH_____________(填“增大”“减小”或“不变”),该电极的电极反应_________。
(3)Cu2O是一种半导体材料,可通过如图所示的电解装置制取,电解总反应式为2Cu+H2O![]() Cu2O+H2↑,阴极的电极反应式是_____________________。用镍氢电池作为电源进行电解,当电池中有1molH2消耗时,Cu2O的理论产量为___________g。
Cu2O+H2↑,阴极的电极反应式是_____________________。用镍氢电池作为电源进行电解,当电池中有1molH2消耗时,Cu2O的理论产量为___________g。

(4)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的______________腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的____________(填“正”或“负”)极相连。利用_____________保护法防止其被腐蚀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠样品中含有少量的杂质Na2SO4,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称。写出有关反应的化学方程式:
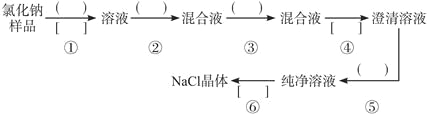
(1)操作①、②、③、⑤中所需加入试剂分别为________、_________、_________、________。
(2)操作①、④、⑥的操作名称分别为_________、_________、_________。
(3)写出有关的化学方程式:
第②步:_____________________________。
第⑤步:_____________________________。
(4)操作④所用到的玻璃仪器有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别用等量的铁与足量的稀硫酸和足量的CuO制备单质铜,有人设计了以下两种方案:
①![]() ,②
,②![]() 。对制备得到Cu的量,下列判断正确的是( )
。对制备得到Cu的量,下列判断正确的是( )
A.一样多 B.① 多 C.② 多 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知吸热反应2CO(g) = 2C(s)+O2(g) ,设ΔH 和ΔS不随温度而变,下列说法中正确的是
A. 低温下能自发进行 B. 高温下能自发进行
C. 任何温度下都能自发进行 D. 任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
![]()
(1)下图中表示NO2的变化的曲线是___________。用O2表示从0~2s内该反应的平均速率v=________________________。
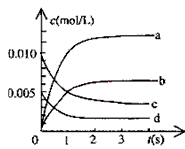
(2)能说明该反应已达到平衡状态的是___________ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________ 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题 :
溶质的物质的量浓度/ | 溶液的密度/ |
| |
硫酸 |
|
| |
氨水 |
|
|
(1)表中硫酸的质量分数为__________(不写单位,用含![]() 、
、![]() 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为![]()
![]() 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________![]() 。
。
(3)物质的量浓度为![]()
![]() 的氨水与
的氨水与![]()
![]()
![]() 的氨水等质量混合,所得溶液的密度______(填
的氨水等质量混合,所得溶液的密度______(填
“大于”、“小于”或“等于”,下同) ![]()
![]() ,所得溶液的物质的量浓度________
,所得溶液的物质的量浓度________![]()
![]()
![]()
(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
甲:Fe2O3、NO2乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2丁:FeO、NO2、N2
(1).实验前,小组成员经讨论认定猜想丁不成立,理由是__________________.
针对上述猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):
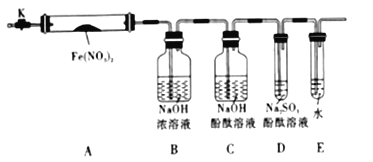
(2).实验过程
①仪器连接后,放人固体试剂之前,应______________
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,___________,后再关闭K,用酒精灯加热
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象.
(3).实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有____________。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检侧到的原因是_________________。
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式______________,通入O2的物质的量为_____________。
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。写一点不足之处:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com