
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生的CO2和H2O的质量,来确定有机物分子式。
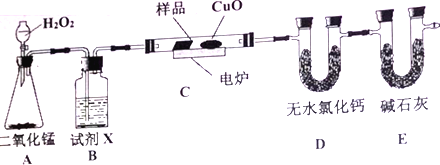
请回答下列问题:
(1)A装置是提供实验所需的O2,则A装置中二氧化锰的作用是____________________; B装置中试剂X可选用______________________。
(2)D装置中无水氯化钙的作用是____________________;E装置中碱石灰的作用是______________。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为______________________。
(4)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1:3
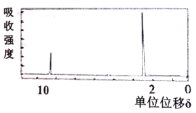
则其结构简式为____________________;若符合下列条件,则该有机物的结构简式为____________________。
①环状化合物 ②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个E装置,其主要目的是__________________________________。
【答案】 过氧化氢分解的催化剂 浓硫酸 吸收生成的水 吸收生成的二氧化碳 C2H4O CH3CHO 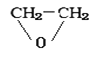 吸收空气中的二氧化碳和水蒸汽
吸收空气中的二氧化碳和水蒸汽
【解析】实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式,因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A是生成氧气的装置,B用于干燥通入C中的氧气的,C是在电炉加热时用纯氧气氧化管内样品,D用来吸收水,测定生成水的质量,E用来吸收二氧化碳,测定生成二氧化碳的质量;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2。
(1)A装置是提供实验所需的O2,则A装置中二氧化锰是催化剂; B装置用于干燥通入C中的氧气,试剂X可选用浓硫酸,故答案为:过氧化氢分解的催化剂;浓硫酸;
(2)D装置中无水氯化钙是吸收生成的水;E装置中碱石灰是吸收生成的二氧化碳,故答案为:吸收生成的水;吸收生成的二氧化碳;
(3)E管质量增加0.88g为二氧化碳的质量,可得碳元素的质量:0.88g×![]() =0.24g,D管质量增加0.36g是水的质量,可得氢元素的质量:0.36g×
=0.24g,D管质量增加0.36g是水的质量,可得氢元素的质量:0.36g×![]() =0.04g,从而可推出含氧元素的质量为:0.44-0.24-0.04=0.16g,设最简式为CXHYOZ,则X:Y:Z=
=0.04g,从而可推出含氧元素的质量为:0.44-0.24-0.04=0.16g,设最简式为CXHYOZ,则X:Y:Z=![]() :
:![]() :
:![]() =2:4:1,即最简式为C2H4O,故答案为:C2H4O;
=2:4:1,即最简式为C2H4O,故答案为:C2H4O;
(4)根据该有机物的核磁共振氢谱图,峰面积之比为1:3,则其结构简式为CH3CHO;若符合下列条件:①环状化合物,②只有一种类型的氢原子,说明结构中含有2个CH2,且具有对称性,则该有机物的结构简式为![]() ,故答案为:CH3CHO;
,故答案为:CH3CHO;![]() ;
;
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个E装置,防止E吸收空气中的二氧化碳和水蒸汽,使得二氧化碳的质量产生误差,故答案为:吸收空气中的二氧化碳和水蒸汽。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是
A.Na+、OH-、SiO32-、Cl-B.Fe3+、 NH4+、SCN-、Cl-
C.Fe2+ 、H+、Na+ 、MnO4-D.Na+、AlO2-、SO42-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不一定正确的是()
A. 原子半径:![]()
B. 工业冶炼Y的方法是电解熔融Y的氧化物
C. W和X组成的化合物为碱性氧化物
D. 向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是 ( )
A.加入Al生成H2的溶液:CO32-、NH4+、Cl-、K+
B.酸性溶液中:K+、Na+、SiO32-、Cl-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.硫酸钠的溶液中:Mg2+、NO3-、K+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氨水逐滴加入到稀盐酸中,使溶液为中性,则此时
A.[NH4+]=[Cl-]B.[NH4+]>[Cl-]
C.[NH4+]<[Cl-]D.[NH4+]与[Cl-]之间关系不确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予研究“分子机器的设计与合成”的三位科学家。轮烷是一种分子机器的轮子,合成轮烷的基本原料有苯、丙烯、二氯甲烷、戊醇。下列说法正确的是( )
A. 苯能与溴水发生加成反应 B. 丙烯能被酸性KMnO4氧化
C. 戊醇易溶于水 D. 二氯甲烷有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是____和____(填化学式,且相对分子质量小的写在第一个空)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时,产生棕黄色沉淀(红白混合颜色),向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则X为____。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液不显中性,原因主要为______________________________(用离子方程式表示)。
(4)将0.02 mol A与0.01 mol C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为_____。
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的____________(填相应的离子符号)。有关反应的离子方程式为_______________________________________________。
(6)利用上述已经确定的物质,可能检验出D、E中的阳离子。请简述实验操作步骤、现象及结论:__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
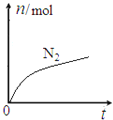
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com