
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
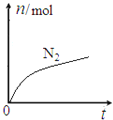
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
【答案】C
【解析】
N2物质的量随着时间的推移逐渐增大,N2为生成物,根据N守恒,NH4+为反应物,NH4+被氧化成N2,则ClO-被还原成Cl-,用化合价升降法配平,得出反应的离子方程式为:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。
N2物质的量随着时间的推移逐渐增大,N2为生成物,根据N守恒,NH4+为反应物,NH4+被氧化成N2,则ClO-被还原成Cl-。
A项,根据上述分析,该反应的氧化剂是ClO-,还原产物是Cl-,N2是氧化产物,A项错误;
B项,该反应中还原剂为NH4+,反应中N元素的化合价由-3价升高至0价,消耗1mol还原剂NH4+,转移3mol电子,B项错误;
C项,在反应中N元素的化合价由-3价升至0价,Cl元素的化合价由+1价降至-1价,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O,反应生成H2O和H+,水是生成物,且反应后溶液的酸性明显增强,C项正确;
D项,1mol氧化剂ClO-得到2mol电子,1mol还原剂NH4+失去3mol电子,根据得失电子总数相等,氧化剂与还原剂物质的量之比为3:2,D项错误;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
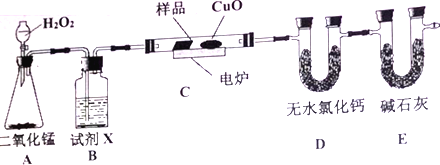
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生的CO2和H2O的质量,来确定有机物分子式。
请回答下列问题:
(1)A装置是提供实验所需的O2,则A装置中二氧化锰的作用是____________________; B装置中试剂X可选用______________________。
(2)D装置中无水氯化钙的作用是____________________;E装置中碱石灰的作用是______________。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为______________________。
(4)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1:3
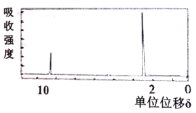
则其结构简式为____________________;若符合下列条件,则该有机物的结构简式为____________________。
①环状化合物 ②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个E装置,其主要目的是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、石油、天然气是重要的能源和化工原料,下列说法正确的是
A.石油裂解得到的汽油是纯净物B.石油产品都可用于聚合反应
C.水煤气是通过煤的液化得到的气态燃料D.天然气是清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是
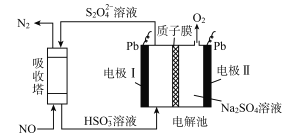
A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
D. 每处理1 mol NO电解池质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置(启普发生器)制取氢气,欲使得到氢气的速率加快,下列措施可行的是
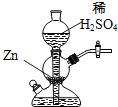
A. 将稀硫酸改为浓硫酸
B. 向稀硫酸中加入少量![]() 固体
固体
C. 向稀硫酸中加入![]() 溶液
溶液
D. 给装置中发生反应的部分加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
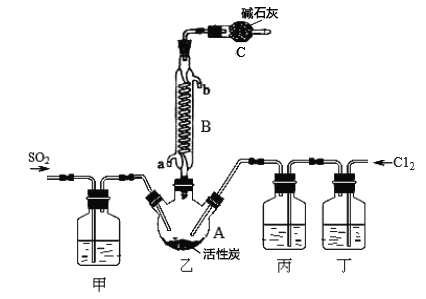
(1)写出浓盐酸和氯酸钾反应制取Cl2的离子方程式_________________。
(2)丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
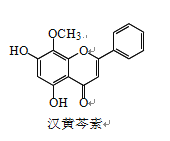
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com