
【题目】完成下面几个小题:
(1)写出硫酸铁在水溶液中电离的电离方程式
(2)用双线桥法,标出下列氧化还原反应的电子转移方向和电子总数
2FeCl3+Fe=3FeCl2 氧化剂是 (填化学式)
(3)氨的催化氧化是工业上制硝酸的基础:4NH3+5O2 ![]() 4NO+6H2O,其中作为还原剂的物质是(填化学式);若反应中生成了0.2mol NO,则转移 mol电子,
4NO+6H2O,其中作为还原剂的物质是(填化学式);若反应中生成了0.2mol NO,则转移 mol电子,
(4)在一定条件下,RO3n﹣ 和氯气可发生如下反应:RO3n﹣+Cl2+2OH﹣=RO42﹣+2Cl﹣+H2O由以上反应可知在上过程中RO3n﹣被(填“氧化”或“还原”),RO3n﹣中元素R的化合价是 .
【答案】
(1)Fe2(SO4)3=2Fe3++2SO42﹣
(2)![]() ;FeCl3
;FeCl3
(3)NH3;1
(4)氧化;+4
【解析】解:(1)硫酸铁为强电解质,完全电离,电离方程式为Fe2(SO4)3=2Fe3++2SO42﹣ , 所以答案是:Fe2(SO4)3=2Fe3++2SO42﹣;(2)只有Fe元素化合价发生变化,分别由+3价、0价变化为+2价,电子转移方向和电子总数可表示为 ![]() ,FeCl3为氧化剂,
,FeCl3为氧化剂,
所以答案是: ![]() ; FeCl3;(3)反应4NH3+5O2
; FeCl3;(3)反应4NH3+5O2 ![]() 4NO+6H2O中,N元素化合价由﹣3价升高到+2价,O元素化合价由0价降低到﹣2价,NH3为还原剂,若反应中生成了0.2mol NO,则转移1mol电子,
4NO+6H2O中,N元素化合价由﹣3价升高到+2价,O元素化合价由0价降低到﹣2价,NH3为还原剂,若反应中生成了0.2mol NO,则转移1mol电子,
所以答案是:NH3;1;(4)由电荷守恒可知n=2,R元素化合价由+4价升高到+6价,被氧化,所以答案是:氧化;+4.


科目:高中化学 来源: 题型:
【题目】物质在水溶液中有不同的性质。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有_____________。
a.溶液中氢氧离子浓度 b.氨水的电离程度c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________________(填“相同”或“不相同”),其原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 .
请回答下列问题:
(1)图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;
(2)图中△H=kJmol﹣1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05molL﹣1min﹣1 , 则υ(O2)=molL﹣1min﹣1、υ(SO3)=molL﹣1min﹣1;
(5)已知单质硫的燃烧热为296kJmol﹣1 , 计算由S(s)生成3molSO3(g)的△H(要求计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程: 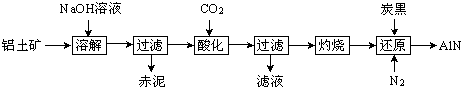
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH 赤泥的主要成分为(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为 .
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示. (已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
Na | Cu | Al | Fe | |
熔点/℃ | 97.5 | 1083 | 660 | 1535 |
沸点/℃ | 883 | 2595 | 2200 | 3000 |
根据以上数据判断其中不能形成合金的是( )
A. Cu和NaB. Fe和Cu
C. Fe和AlD. Al和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A. K+、Na+、Cl-、NO3- B. K+、NO3-、OH-、HCO3-
C. Na+、OH-、Cl-、NO3- D. MnO4-、K+、S2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.实验室用加热NH4Cl固体的方法制备NH3
B.用点燃的火柴在液化气钢瓶口检验是否漏气
C.工业上用SO2漂白纸浆、毛、丝、草帽辫等
D.保存金属钠的仓库着火可以用二氧化碳灭火器去灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH2OH(CHOH)4CHO是葡萄糖的结构简式,它不可能发生的化学反应是( )
A.燃烧
B.银镜反应
C.水解反应
D.与新制备的Cu(OH)2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com