
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要.
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H0(填“>”或“<”). 
(2)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引起N2和O2反应,其能量变化如图2所示,写出该反应的热化学方程式 .
【答案】
(1)>
(2)N2(g)+O2(g)=2NO(g)△H=+183 kJ?mol﹣1
【解析】解:(1)根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应,△H>0.
所以答案是:>;(2)该反应中的反应热=反应物的键能和﹣生成物的键能和=(945+498)kJ/mol﹣2×630kJ/mol=+183kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJmol﹣1 ,
所以答案是:N2(g)+O2(g)=2NO(g)△H=+183 kJmol﹣1 .
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热).


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应2NO2(g) ![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列说法正确的是
A. 实验2使用了比实验1效率更高的催化剂
B. 实验2的反应容器体积比实验1的小
C. 通过实验2和实验3可判断该反应是放热反应
D. 实验2的平衡常数比实验3的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷的电子式为 , 碳氢键之间键角为 . 甲烷和氯气在光照下发生取代反应,生成种产物.产物中常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在恒容容器中进行,达到平衡状态的标志是
2NO+O2在恒容容器中进行,达到平衡状态的标志是
①单位时间内生成n molO2,的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
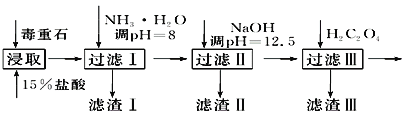
(1)毒重石用盐酸浸取前需充分研磨,目的是_______________________________________;实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)查阅有关资料获得沉淀各种杂质离子的pH见下表:
沉淀杂质离子 | Ca2+ | Mg2+ | Fe3+ |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去______(填离子符号);滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9)。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ.准确移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入几滴酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ.准确移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(选填“上方”或“下方”)。BaCl2溶液的浓度为________________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则所测得Ba2+浓度测量值将________(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锂离子电池的回收利用的意义重大,其正极废料的主要成分是LiCoO2、铝、炭黑及其他杂质,回收利用的流程如下:

已知“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
(1)步骤①中铝溶解的离子方程式为_________________,固体X的成分是_________。
(2)步骤②中LiCoO2固体溶解的化学方程式为_______________ ,该反应的还原剂是_______。
(3)母液中含量最大的三种离子是_________。
(4) (NH4)2C2O4是一种化学实验室常用的试剂,预测其溶解性___________(填“可溶于水”或“不溶于水”)。一定温度下,(NH4)2C2O4固体可分解出NH3和CO等物质,思考其它的产物并写出其分解的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下使其反应:H2(g)+I2(g)![]() 2HI(g) △H<0.
2HI(g) △H<0.
(1)保持容器的容积不变,向其中加入1mol H2,反应速率_____(填“加快”“减慢”“无影响”), 理由是_______________________________________________________________.
(2)保持容器的容积不变,向其中加入1molN2(不参与反应),反应速率______.(填“加快”“减慢”“无影响”) 理由是________________________________________________.
(3)保持容器内气体的压强不变,向其中加入1mol N2(不参与反应),反应速率____.(填“加快”“减慢”“无影响”) 理由是_____________________________________________.
(4)保持容器内气体的压强不变,向其中加入1mol H2和1mol I2(g),反应速率______.(填“加快”“减慢”“无影响”) 理由是____________________________________________.
(5)提高起始的反应温度,反应速率______.(填“加快”“减慢”“无影响”) 理由是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有_________。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。

①为了保证实验成功,装置A应具有的现象是___________,搅拌的目的是___________。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是_______________________________。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4·7H2O)。实验模拟制备皓矾工业流程如下:

①氧化中加入硫酸铁发生反应的离子方程式是____________________。
②加入Zn粉的目的是_________________________________。
③固体A主要成分是__________________。
④操作b得到纯净皓矾晶体,必要的操作是蒸发浓缩、__________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com