
【题目】向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( )
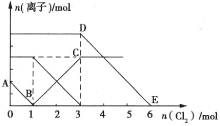
A.线段BC代表Cl-物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3
【答案】C
【解析】
还原性为I->Fe2+>Br-,则AB发生2I-+Cl2═I2+2Cl-,I-反应完毕再发生BC段:2Fe2++Cl2═2Fe3++2Cl-,最后发生DE段反应2Br-+Cl2═Br2+2Cl-。
A.B点时溶液中I-完全反应,溶液中存在Fe2+和Br-,BC段发生2Fe2++Cl2═2Fe3++2Cl-,代表Fe3+的物质的量的变化情况,故A错误;
B.由图可知,BC段发生2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕消耗氯气2mol,由方程式可知n(Fe2+)=2×2mol=4mol,则n(FeBr2)=4mol,缺少溶液的体积,故B错误;
C.AB段发生2I-+Cl2═I2+2Cl-,2mol的I-消耗1mol氯气,BC段发生2Fe2++Cl2═2Fe3++2Cl-,余下的1mol氯气再与2molFe2+反应,参加反应的n(Fe2+):n(I-)=1:1,通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-,故C正确;
D.由图可知AB段消耗氯气1mol,发生2I-+Cl2═I2+2Cl-,故n(I-)=2n(Cl2)=2mol,BC段发生2Fe2++Cl2═2Fe3++2Cl-,消耗氯气2mol,故n(Fe2+)=2n(Cl2)=2×2mol=4mol,DE段发生2Br-+Cl2═Br2+2Cl-,消耗氯气3mol,故n(Br-)=2n(Cl2)=6mol,故原溶液中n(Fe2+):n(I-):n(Br-)=4mol:2mol:6mol=2:1:3,故D错误;
故选C。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L 乙醇中含有碳原子数为2NA
B.6.0 g的SiO2固体含有0.1NA个SiO2分子
C.1L 0.5mol·L-1醋酸中含CH3COO-为0.5NA
D.12.0 g NaHSO4晶体中阴阳离子数为0.2 N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A.铁被氧化的电极反应式为Fe3e=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.一段时间后, 右侧导管液面会下降
D.活性炭的存在会加速铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)8.5g氢氧根离子含有的电子数目为_______。
(2)3.1gNa2X含有Na0.1mol,则Na2X的摩尔质量为______,X的相对原子质量为_______。
(3)若1gCO2中含有x个原子,则阿伏加德罗常数可表示为_______。
(4)由硫酸钾、 硫酸铁和硫酸组成的混合溶液,其中c(H)0.1mol/L,c(Fe3)0.3mol/L,c(SO42)0.6mol/L,则c(K)为_______。
(5)相同物质的质量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1时,消耗三种盐溶液的体积比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HNO2是一种弱酸,向NaNO2中加入强酸可生成HNO2,HNO2不稳定,易分解成NO和NO2气体;HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C解毒,维生素C在解毒的过程中表现出_____(填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分NaNO2和NaCl的是(_____)
A.加入盐酸,观察是否有气泡产生
B.加入AgNO3溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
(3)![]() 可以与Fe2+反应制备Fe2O3纳米颗粒。
可以与Fe2+反应制备Fe2O3纳米颗粒。
① 若![]() 与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
___Fe2++___![]() +___H2O2+___OH-=___Fe2O3+___
+___H2O2+___OH-=___Fe2O3+___![]() +___H2O
+___H2O
② 下列关于该反应的说法中正确的是_____(填序号)。
A.该反应中![]() 表现了氧化性
表现了氧化性
B.已知生成的Fe2O3纳米颗粒直径为10纳米,则Fe2O3纳米颗粒为胶体
C.该反应中H2O2作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是( )
A.推广使用无磷洗衣粉主要是为了防止水体富营养化
B.高铁酸钾![]() 是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质
是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质
C.石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化
D.测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素原子示踪法等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁.其生产工艺流程如下:
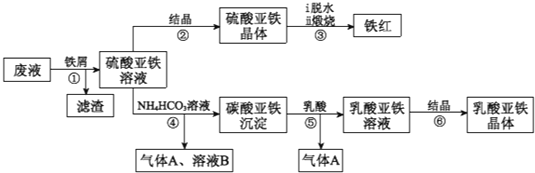
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2xH2O↓+H2SO4.
请回答:
(1)步骤①所得滤渣的主要成分为_____________,
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________,
(3)步骤④需控制反应温度低于35℃,其目的是_____________,
(4)步骤④的离子方程式是_____________,
(5)已知:FeCO3(S)![]() Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________,
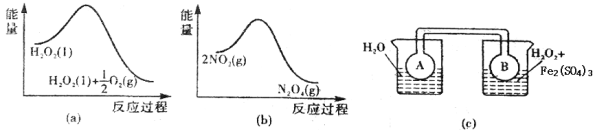
(7)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾 Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com