
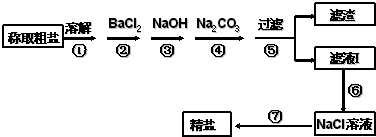
 四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):
四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).| 滴定 | 标准NaOH溶液体积/mL | |
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第一次 | 0.02 | 25.00 |
| 第二次 | 0.01 | 25.03 |
| 第三次 | 0.03 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉-KI溶液 |
| B、NaOH溶液 |
| C、酚酞溶液 |
| D、硝酸酸化的硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(4)(6)(7) |
| B、(4)(6)(9)(10) |
| C、(3)(5)(6)(8) |
| D、(5)(6)(8)(9) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe+H2SO4=FeSO4+H2↑ |
| B、CO+CuO═Cu+CO2↑ |
| C、Cu2(OH)2CO3═2CuO+H2O+CO2↑ |
| D、4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com