
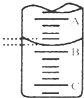
 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).| 滴定 | 标准NaOH溶液体积/mL | |
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第一次 | 0.02 | 25.00 |
| 第二次 | 0.01 | 25.03 |
| 第三次 | 0.03 | 26.35 |
| V(标准)×c(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| 0.20mol/L×25.00mL |
| 20.00ml |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
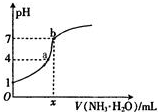
| A、x=20 |
| B、稀H2SO4的浓度为0.10mol/L |
| C、a点可能是:c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
| D、b点表示稀H2SO4和氨水恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
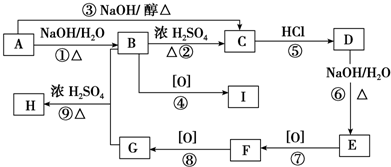
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0 | B、+1 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
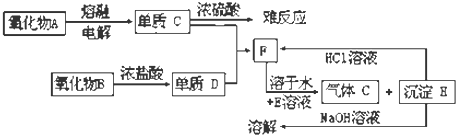
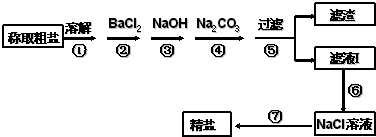 四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):
四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com