
| A、0 | B、+1 | C、+3 | D、+4 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| B、盐酸可作铁制品的除锈剂 |
| C、实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
| D、加热蒸干AlCl3溶液得到Al(OH)3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
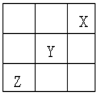 (1)根据氢元素最高正价最低负价的绝对值相等,有人提议把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在
(1)根据氢元素最高正价最低负价的绝对值相等,有人提议把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.01mol?L-1NH4Cl溶液 |
| B、25℃时,0.01mol?L-1NaHSO4溶液 |
| C、100℃时,0.01mol?L-1NaNO3溶液 |
| D、25℃时,0.01mol?L-1NaF溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
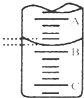 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).| 滴定 | 标准NaOH溶液体积/mL | |
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第一次 | 0.02 | 25.00 |
| 第二次 | 0.01 | 25.03 |
| 第三次 | 0.03 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3═2Al3++3SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═CH3COO-+H+ |
| D、Na2CO3═Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20℃,10 mL 0.1mol?L-1硫酸 |
| B、20℃,5 mL 0.1 mol?L-1硫酸和5 mL水 |
| C、30℃,10 mL 1 mol?L-1硫酸 |
| D、30℃,5 mL 1 mol?L-1硫酸和5 mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com