
【题目】下列说法正确的是
A.己知2C+SiO2![]() Si+2CO↑,说明Si的非金属性比C强
Si+2CO↑,说明Si的非金属性比C强
B.电子层数越多,原子半径一定越大
C.单质中不可能含有离子键
D.第ⅥA族元素的氢化物中,稳定性最强的其沸点最低
【答案】C
【解析】
非金属性越强,对应的单质的氧化性越强,还原性越弱;电子层数只是影响原子半径的一个因素;离子键是阴阳离子间的静电作用,单质中不含阴阳离子;第ⅥA族元素的氢化物中,稳定性最强为水,含有氢键,沸点反常的高。
A.由元素周期律可知,同一族,从上至下,非金属减弱,故C的非金属性比Si强,题意不符,故A错误;
B.电子层数只是影响原子半径的一个因素,还要考虑原子核对电子的吸引,核外电子多,相应的核内质子数也多,由于静电力的增强可能会引起原子半径的减小,如Li>Cl,故B错误;
C.离子键是阴阳离子间的静电作用,单质中不含阴阳离子,一般单质是由原子直接构成或同原子间以共价键结合,故不含离子键,C正确;
D.第ⅥA族元素的氢化物中,稳定性与元素的非金属性一致,稳定性最强为水,水含有分子间氢键,沸点最高,故D错误;
答案选C。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示.下列说法正确的是
与pH的关系如图所示.下列说法正确的是![]()
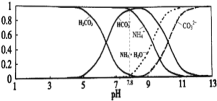
A.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
B.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
C.往该溶液中逐滴滴加氢氧化钠时![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.通过分析可知常温下![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中![]() 下列分析正确的是
下列分析正确的是![]()
![]()

A. ![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B. ![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C. ![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. ![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和电解CuSO4溶液,其中乙装置中X为阳离子交换膜。
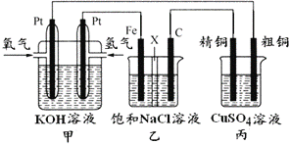
根据要求回答相关问题:
(1)通入氧气的电极为___(填“正极”或“负极”),负极的电极反应式为___。
(2)铁电极为___(填“阳极”或“阴极”),石墨电极(C)的电极反应式为___。
(3)乙装置中电解的总反应的离子方程式为___。
(4)若在标准状况下,有1.12L氧气参加反应,丙装置中阴极增重的质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示正确的是
A.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有12个
B.酒石酸(HOOC-CHOH-CHOH-COOH)不存在手性碳原子
C.熔点:MgBr2<SiCl4<SiC
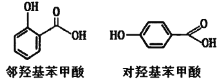
D.邻羟基苯甲酸分子内形成了氢键,所以沸点高于对羟基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)=1.3×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液。下列叙述中不正确的是
A.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com