
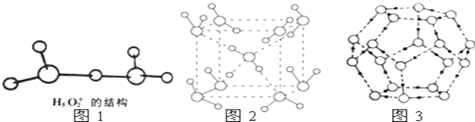
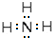 .
.分析 (1)同周期中稀有气体的电离能最大,其它元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
(2)原子总数相等、价电子总数也相等的微粒互为等电子体;
(3)①铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,1个H2O含2个O-H键,则[Cu(H2O)4]2+含有12个σ键;
②氢离子含有空轨道,氧原子含有孤电子对,能形成配位键,O-H为极性键,单键属于σ键,O原子与H原子之间会形成氢键;
(4)暖冰为分子晶体,暖冰中水分子之间主要的作用力为氢键,电场作用下,水分子间更易制得“暖冰”;
(5)①以立方体中的水分子为研究对象,每个水分子形成4条氢键;每一条氢键连接2个水分子,故冰晶体中氢键数目为水分子数目的2倍;
②以立方体中的水分子为研究对象,每个水分子与周围4个水分子形成4个氢键,为正四面体构型,SiO2空间连接方式与这种冰连接类似;
③设体心立方中晶胞的棱长为X,O-H…O距离为A,则3X2=(2A)2,故X=$\frac{2A}{\sqrt{3}}$,利用均摊法计算晶胞中水分子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算;
(6)①正十二面体每三个相邻的面都有一个公共顶点,这个公共顶点分别是这三个小正五边形的一个顶点,对角线为任意两点间的连线减去棱数;
②冰融化为液态水时,水分子数目不变,利用均摊法计算图2、图3中每个水分子形成氢键,减少的氢键即为破坏氢键;.
解答 解:(1)同一周期内主族元素的第一电离能从左到右在总体增大的趋势中有些曲折.当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大,由于N元素的2p能级3个轨道处于半满,He元素的2P能级3个轨道处于全满,所以第二周期的第一电离能大小顺序是I1(He)>I1(F)>I1(N)>I1(O)>I1(C)>I1(Be)>I1(B),氧的第一电离能在同周期元素中由大到小排第4位,
故答案为:4;
(2)H3O+中O原子的质子数为8,H原子的质子数为1,所以H3O+的质子数为11,电子数=11-1=10,NH3的原子数目为4,电子数目为10,则与H3O+互为等电子体,电子式为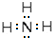 ,
,
故答案为: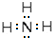 ;
;
(3)①Cu2+含有空轨道,H2O含有孤对电子,可形成配位键,铜离子配体数为4,配离子[Cu(H2O)4]2+中1个Cu2+与4个H2O形成配位键,1个H2O含2个O-H键,所以1mol水合铜离子中含有σ键数目为12NA,
故答案为:12NA;②根据图1水合盐酸晶体H5O2+•Cl-中H5O2+离子的结构知:
a.氢离子含有空轨道,氧原子含有孤电子对,所以能形成配位键;
b.O-H形成极性键;
c.无非极性键;
d.因H5O2+中无阴阳离子,所以不存在离子键;
e.因H5O2+中无金属所以不存在金属键;
f.氢键存在于不直接相连的H与电负性较大的O原子间;
g.因H5O2+中无分子,所以不存在范德华力;
h.因H5O2+中无双键或三键,所以不存在π键;
i.O-H形成σ键,
故答案为:a b f i;
(4)水分子之间主要通过氢键形成固体,水分子是极性分子,在电场作用下定向有规则的排列,水分子间更易形成氢键,
故答案为:水分子是极性分子,在电场作用下定向有规则的排列,分子间通过氢键结合而成固体;
(5)①晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有半个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2 mol氢键,
故答案为:2;
②二氧化硅是原子晶体,Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,以立方体中的水分子为研究对象,每个水分子形成4条氢键,SiO2空间连接方式与这种冰连接类似,
故答案为:SiO2;
③体心立方晶胞中水分子个数=1+8×$\frac{1}{8}$=2;设体心立方中晶胞的棱长为X,O-H…O距离为A,则3X2=(2A)2,体心立方的密度ρ=$\frac{m}{V}$=$\frac{2m}{{N}_{A}×{X}^{3}}$
=$\frac{18×2}{(\frac{2×295×1{0}^{-10}}{\sqrt{3}})×6.02×1{0}^{23}}$=1.51g/cm3,
故答案为:$\frac{18×2}{(\frac{2×295×1{0}^{-10}}{\sqrt{3}})×6.02×1{0}^{23}}$=1.51;
(6)①这个正十二面体的顶点的个数是原来12个小正五边形的顶点总和的$\frac{1}{3}$,由此即可得出正十二面体的顶点个数;5×12×$\frac{1}{3}$=20(个),从20个点选两个就可以连线,棱数为:5×$12×\frac{1}{2}$=30,对角线为任意两点间的连线减去棱数,即$\frac{20×19}{2}$-30=160,
故答案为:20;160;
②冰融化为液态水时,水分子数目不变,图2中每个水分子平衡含有氢键数目为4×$\frac{1}{2}$=2,图3中每个水分子平衡含有氢键数目为3×$\frac{1}{2}$=1.5,则该冰熔化过程中氢键被破坏的百分比为 $\frac{2-1.5}{2}$×100%=25%,
故答案为:25%.
点评 本题考查较为综合,涉及分子的立体构型、晶胞的计算,氢键、分子结构等知识,注意晶体类型的有关计算,需要全面掌握基础知识,并能运用分析解决问题,难点是晶胞计算,题目难点中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | 体系的总压强不变 | |
| B. | 体系内各物质的质量分数不再发生变化 | |
| C. | 体系内气体密度不再发生变化 | |
| D. | 单位时间消耗0.1molCO(g)的同时生成0.1molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
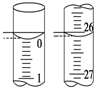 环境监测测定水中溶解氧的方法是:
环境监测测定水中溶解氧的方法是:| 滴定次数 | 待测液的体积/mL | 0.1000mol•L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
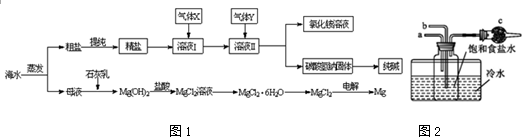
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Fe3+Br2 | Cl- | |
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组的反应可能有一种或两种元素被氧化 | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比水小,能浮在水面上 | |
| B. | 接近沸点的水蒸气的相对分子质量测量值大于18 | |
| C. | 邻羟基苯甲醛的沸点低于对羟基苯甲醛 | |
| D. | H2O比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
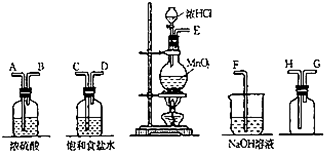 实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 反应KIO3+6HI═KI+3H2O+3I2中,生成3molI2转移电子的总数为5NA | |
| D. | 12g石墨和C60的混合物中质子总数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
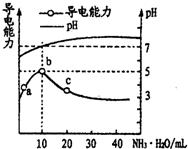
| A. | HR为强酸 | |
| B. | a、b、c三点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com