
����Ŀ��������������{[CH3CH(OH)COO]2Fe��3H2O}(��Է���������288)����������FeCO3��Ӧ�Ƶã���������ˮ�������������Ҵ��������ֽ⣬��һ�ֺܺõIJ�������
I���Ʊ�̼��������װ����ͼ��ʾ��
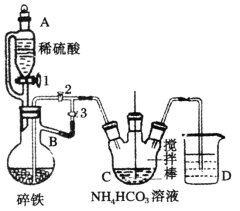
(1)����B��������_________________________��
(2)ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬��Ŀ���ǣ�__________��Ȼ��رջ���1���������IJ����ǣ�______��C�з�����Ӧ�����ӷ���ʽΪ_____________��
���Ʊ�����������
����FeCO3�����������������Һ����75���½���ʹ֮��ַ�Ӧ��
(3)�÷�Ӧ��ѧ����ʽΪ______��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ����____����Ӧ������������Һ�л��������������ķ����ǣ�_________����ȴ�ᾧ�����ˣ�_________�����
�������������崿�ȵIJ�����
(4)��K2Cr2O7�ζ����ⶨ��Ʒ��Fe2+�ĺ���������Ʒ���ȣ���ȡ6.00g��Ʒ���Ƴ�250��00mL��Һ��ȡ25��00mL��0.0167mol��L-1��K2Cr2O7����Һ�ζ����յ㣬���ı�Һ20��00mL�����Ʒ��������������Ĵ���Ϊ___(������������ʾ)��
���𰸡�������ƿ �ž�װ���ڵĿ�������ֹ������������ �رջ���3������2 Fe2++2HCO3-==FeCO3��+CO2��+H2O 2CH3CH(OH)COOH+FeCO3==[CH3CH(OH)COO]2Fe+CO2��+H2O �������� ������������������ �������Ҵ�ϴ�� 96.2��
��������
(1)��������������;��д����B�����ơ�
(2)��������ϡ���ᷴӦһ��ʱ�䣬�����������ų��������ų������������������뵽����װ������̼�����������Ӧ����̼��������
(3)�����̼��������Ӧ�������������Ͷ�����̼���������۷�ֹ�����������ʣ���Ӧ������Ҫ���������������������������������������Ҵ�������������Ҵ�ϴ�ӡ�
(4)���ݹ�ϵʽ�������������ʵ������ټ��㴿�ȡ�
(1)����B��������������ƿ���ʴ�Ϊ��������ƿ��
(2)ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬�����������ų���������Ŀ���ǣ��ž�װ���ڵĿ�������ֹ��������������Ȼ��رջ���1���������IJ����ǣ��رջ���3������2��C�з�����Ӧ�����ӷ���ʽΪFe2++2HCO3��= FeCO3��+CO2��+H2O���ʴ�Ϊ���ž�װ���ڵĿ�������ֹ���������������رջ���3������2��Fe2++2HCO3��= FeCO3��+CO2��+H2O��
(3)�����̼��������Ӧ�������������Ͷ�����̼���䷴Ӧ��ѧ����ʽΪ2CH3CH(OH)COOH + FeCO3==[CH3CH(OH)COO]2Fe+CO2��+H2O��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ�������ۣ���Ӧ������������Һ�л�������������壬��Ҫ�����������������������Ҫ�����������������ɣ����˺����������Ҵ�ϴ�ӣ��ʴ�Ϊ��2CH3CH(OH)COOH + FeCO3==[CH3CH(OH)COO]2Fe+CO2��+H2O�������������������ɣ��������Ҵ�ϴ�ӡ�
(4) K2Cr2O7 ���� 6 Fe2+
1mol 6mol
0.0167mol��L-1��0.02L xmol
1mol��0.0167mol��L-1��0.02L = 6mol��xmol
���x = 2.004��10-3mol
![]() ���ʴ�Ϊ96.2%��
���ʴ�Ϊ96.2%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ,�ش���������:
��1����12.5g CuSO4��5H2O����ˮ���γ�1L��Һ�����ʵ����ʵ���Ũ��Ϊ_________mol��L��1
��2����ԭ�ӵ����ʵ��������������HCl��H2��NH3��CH4����ͬ��ͬѹ�£��������������֮��V(HCl)��V(H2)��V(NH3)��V(CH4)=______________��
��3������100mL 1.00 mol��L��1H2SO4��Һ����Ҫ����Ͳ��ȡŨ���ᣨ�ܶ�Ϊ1.84g��cm��3��������������Ϊ98%�������Ϊ_____________mL��
��4����Ӧ2K2S+ K2SO3+3H2SO4=3S��+3 K2SO4+3H2O�У��������뻹ԭ�������ʵ���֮��Ϊ______������Ӧ����0.6molS����Ӧ��ת�Ƶĵ���Ϊ____________mol��
��5����������5�����ʣ���CO2 ��Mg ������ ��NaCl ��Na2CO3�������������ڵ���ʵ���_____________������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t ��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t ��ʱAgCl��Ksp��4��10��10 mol2��L��2������˵������ȷ����(����)
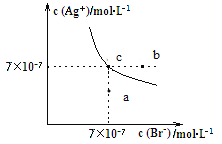
A.��t ��ʱ��AgBr��KspΪ4.9��10��13 mol2��L��2
B.��AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
C.ͼ��a���Ӧ����AgBr�IJ�������Һ
D.��t ��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)��ƽ�ⳣ��K��816
AgBr(s)��Cl��(aq)��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ͼ��ʾ������ӵ����ϵ�������������( )
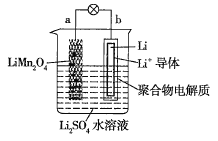
A.a��Ϊ��ص�����
B.�ŵ�ʱ��b���ĵ缫��ӦʽΪLi-e-=Li+
C.�ŵ�ʱ��a���Ԫ�صĻ��ϼ۷����仯
D.�ŵ�ʱ����Һ��Li+��a��Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���ֽ��ܼ��ŵ�����й����Ƴ�������̬������ȼ�ϵ��(SOFC)���õ�صĹ���ԭ����ͼ��ʾ������˵����ȷ����( )
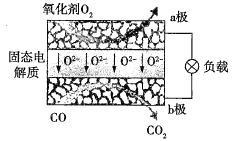
A.����ѡ��NaOH��������̬�����
B.�����ĵ缫��ӦʽΪO2+4e-+2H2O=4OH-
C.���Ӵ�b������������a��
D.����Ӧ��ת��1 mol���ӣ�������22.4 L(��״����)CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯Ϊ���ȷ�Ӧ���ǣ� ��
A.H2O(g)��H2O(l) ��H����44.0 kJ/mol
B.2HI(g)��H2(g)��I2(g) ��H����14.9 kJ/mol
C.�γɻ�ѧ��ʱ���ų�����862 kJ�Ļ�ѧ��Ӧ
D.�����仯��ͼ��ʾ�Ļ�ѧ��Ӧ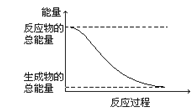
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.50��ʱ��ˮ��0.1mol/L����������0.1mol/LNaOH��Һ�еĵ���̶���ͬ
B.pH����7����Һһ��������
C.ˮ�����ӻ���ʾ��ˮ��Һ����ˮ�������H+��OH-Ũ�ȷ���Kw=c(H+)��c(OH-)
D.��0.06mol��L-1����������Һ��0.1mol��L-1������Һ�������ϣ��û����Һ��pH����13(���Ի�Ϲ�������Һ����仯)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У���ӦaA��g���PbB��g����ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%���� ��
A.ƽ��������Ӧ�����ƶ���B.����A��ת���ʼ�����
C.����B��������������D.a>b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ��ȷ���ǣ� ��
A.������ĵ��뷽��ʽ��HClO=H++ClO��
B.ֻ�������ӵĹ��̲����Է�����
C.HS-ˮ�����ӷ���ʽ��HS-+H2O![]() H3O++S2-
H3O++S2-
D.��֪�к���Ϊ57.3 kJ��mol��1��ϡ��������������ϡ��Һ��Ӧ���Ȼ�ѧ����ʽ��H2SO4 (aq)+2NaOH (aq)== Na2SO4 (aq)+2H2O ( l ) ��H=��114.6 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com