
水热法制备Fe3O4纳米颗粒的总反应为:
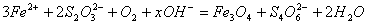 。下列说法正确的是( )
。下列说法正确的是( )
A.硫元素被氧化,铁元素被还原 B. Fe2+、S2O32-都是还原剂
C. x=2 D. 每生成1 mol Fe3O4,则转移电子数为3 mol
科目:高中化学 来源: 题型:
氢氟酸(HF)是一种弱酸。25℃时,向20mLO.1mol•L-1氢氟酸中加入VmL0.1mol•L-1NaOH溶液充分反应。已知: HF(aq)+OH-(aq)═F-(aq)+H2O(1) △H= - 67.7kJ•mol-1,
H+(aq)+OH-(aq)═H2O(1) △H═ - 57.3kJ•mol- 根据题意,下列判断或结论正确的是
A.氢氟酸的电离过程是吸热的
B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol•L-1
C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-)
D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
将5mol/L的AlCl3溶液a mL稀释至b mL,稀释后溶液中Cl-物质的量浓度为
A.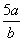 mol/L B.
mol/L B.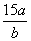 mol/L C.
mol/L C.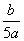 mol/L D.
mol/L D.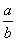 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A.在平衡体系PCl5(g) PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
B.CH3COOH与H18O-CH2CH3发生酯化反应是可逆反应,达到平衡后,18O一定仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里
C.在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃
D.CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ: A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是 (标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
Ⅱ:X、Y、Z为三种不同短周期非金属元素的单质。在一定条件下发生如下反应:

(6)、若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,则:
Y的化学式是 ;生成固体的电子式为 。
(7)、若常温下Y为固体,X、Z为气体,A 在空气中充分燃烧可生成B,B具有漂白性,则:将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为_______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
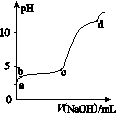
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-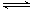
 Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO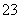
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO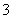 )+c(CO
)+c(CO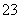 )
)
D. 温度升高,c(HCO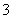 )增大
)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
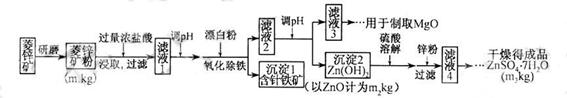
(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Go ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为______。
2”的pH时,理论上可选用的最大区间为______。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c. 纯碱溶液 d.烧碱溶液
纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com