
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ��K | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1���������ǿ����˳��Ϊ_________________(�û�ѧʽ��ʾ����ͬ)��
��2�������£�0.02 mol��L-1��CH3COOH��Һ�ĵ����ԼΪ �����Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ�� ����(���������������=��)��
��3����������CH3COO-��CO32-��HSO3-��SO32-����Һ�н��H+�������ɴ�С��˳��Ϊ_____________��
��4��NaHSO3��Һ�����Ե�ԭ��___________________________(���ӷ���ʽ���ʵ���������)������Һ������Ũ���ɴ�С�Ĺ�ϵ��_______________.
���𰸡���1��H2SO3��CH3COOH��H2CO3��
��2��3��(1��)��(1��)
��3��CO32-��SO32-��CH3COO-��HSO3-
��4��HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-
H2SO3+OH-
HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�����NaHSO3��Һ�����ԡ�
C(Na+)��C(HSO3-)��C(H+)��C(SO32-)��C(OH-)
��������
�����������1�����ݱ������ݿ�֪����ĵ���ƽ�ⳣ����СΪ��H2SO3��CH3COOH��H2CO3��HSO3-��HCO3-������ƽ�ⳣ��Խ������Խǿ�����Ե������ǿ������˳��ΪΪ��H2SO3��CH3COOH��H2CO3��
��2��0.02mol/L�Ĵ�������Һ�д��ڵ���ƽ�⣺CH3COOHCH3COO-+H+�������Һ�д���ĵ����Ϊx������������Ĵ�������ӡ�������Ũ��Ϊ0.02xmol/L�������Ũ��Ϊ0.02(1-x)mol/L�����ݴ���ĵ���ƽ�ⳣ��K=1.8��10-5��֪��K=1.8��10-5=![]() ����ã�x=3%��
����ã�x=3%��
���ڴ��������С�������ᣬpH��ͬ�Ĵ����������ϡ����ͬ���������pH�仯���������pH���������
��3����֪���ԣ�H2SO3��CH3COOH��H2CO3��HSO3-��HCO3-��������Ӷ�Ӧ�������Խǿ����������ӽ������������Խ������CH3COO-��CO32-��HSO3-��SO32-����Һ�н��H+�������ɴ�С�Ĺ�ϵΪ��CO32-��SO32-��CH3COO-��HSO3-��
��4��NaHSO3��Һ�����Ե�ԭ����HSO3-����Һ�д��ڵ����ˮ�⣬ ��HSO3-![]() H++ SO32-, HSO3-+H2O
H++ SO32-, HSO3-+H2O![]() H2SO3+OH-, HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�����NaHSO3��Һ�����ԡ�
H2SO3+OH-, HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�����NaHSO3��Һ�����ԡ�


 С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д� ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ѧʽ�У�ֻ��ʾһ�ִ��������
A. C2H4O B. C3H6 C. C2H3Br D. C6H12O6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������л��е���ϩ����õķ���( )
A. ������������ϩ��Ӧ B. ��ȼ
C. ͨ��������ˮ D. ͨ��KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500mLNH4HCO3��Na2CO3�Ļ����Һ�ֳ���ȷݣ�ȡһ�ݼ��뺬amol�������Ƶ���Һ���ȣ�ǡ��ʹNH![]() ��ȫת��ΪNH3�ݳ�����ȡһ�ݼ��뺬bmolHCl������ǡ�÷�Ӧ��ȫ����û����Һ��c(Na��)Ϊ
��ȫת��ΪNH3�ݳ�����ȡһ�ݼ��뺬bmolHCl������ǡ�÷�Ӧ��ȫ����û����Һ��c(Na��)Ϊ
A��(2b��a) mol/L B��(10b��5a) mol/L
C��![]() mol/L D��
mol/L D��![]() mol/L
mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ����������
����������ֻ��������������Һ�У�Na+��SO42-��NO3-��Mg2+
��pH=11����Һ�У�![]() ��Na+��AlO2����NO3����S2����
��Na+��AlO2����NO3����S2����![]()
��ˮ�����H+Ũ��Ϊ10��12mol��L��1����Һ�У�Cl����![]() ��NO3����
��NO3����![]()
�ܼ���Mg�ܷų�H2����Һ�У�Mg2+��NH4+��Cl����K+��![]()
��ʹ���ȱ�Ƶ���Һ�У�Fe2+��MnO4����NO3����Na+��![]()
��������Һ�У�Fe3+��Na+��NO3����Cl��
A���٢ۢ� B���ڢ� C���٢ڢ� D���ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ijŨ������Լ�ƿ�ϵı�ǩ����ͼ��ʾ,���ݱ�ǩ�ϵ��й����ݻش��������⣺
��1�� ���Լ��� H2SO4�����ʵ���Ũ��Ϊ mol��L-1��

��2��ijͬѧ������920mL���ʵ���Ũ��Ϊ0.30 mol��L-1��ϡ���ᣬ����ѡ������Ϊ mL������ƿ��Ȼ�����ۼ�����Ҫ��ȡ mL����Ũ����(����������С�����һλ)��
��3����Һ���ƵĻ����������£�
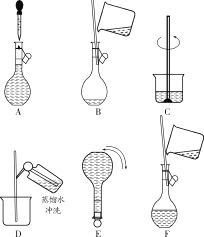
������ʵ�鲽��A��F��ʵ������Ⱥ�˳������
�� �� �� �� �� ��(����ĸ)
��4�����в�����ʹ������Һ�����ʵ���Ũ��ƫ�͵��� ��(����ĸ)
A��Ũ����ϡ�ͺ�δ��ȴ��ת��
B������ƿʹ��ǰ�ڱ�մ��ˮ��
C��������ˮʱ,���������˿̶���
D��ijͬѧ�۲�Һ����������ͼ��ʾ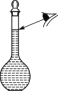
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����ʵ�������ù�ҵԭ���Ʊ������������������������װ�ã�ͼ�мг�װ�þ�����ȥ����
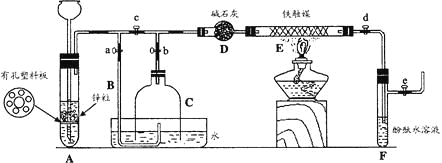
[ʵ�����]
�� ���ʵ��װ�õ������Ժرյ��ɼ�a��b��c��d��e����A�м���п������©��ע��һ����ϡ���ᡣ���ɼ�c��d��e����A����������������F���ڴ��ռ������������䴿�ȡ�
�� �رյ��ɼ�c��ȡ�½�ȥ�ײ���ϸ��ƿC�����ɼ�a��������������B�鴿���ȼ��Ȼ������������ϸ��ƿC������ƿ������ͼ��ʾ������������ƿ��ȼ�գ������Ӻ����Ϩ��
�� �þƾ��Ƽ��ȷ�Ӧ��E������ͨ����������ϸ��ƿC��ˮλ�½���Һ�汣�ֲ���ʱ�����ɼ�b����ϸ��ƿC�����徭D���뷴Ӧ��E��Ƭ�̺�F�е���Һ��졣
�ش��������⣺
��1�������������ȵ�Ŀ���� ��
��2��Cƿ��ˮλ�½���Һ�汣�ֲ���ʱ��Aװ���ڷ����������� ����ֹ��ʵ��װ����ѹǿ����ʱ�ٴ��ɼ�b��ԭ���� ��Cƿ������ijɷ��� ��
��3���ڲ������У��ȼ�������ý��ԭ���� ����Ӧ��E�з�����Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ƽ�������и���һֻʢ������ϡ������ձ�����ʱ��ƽƽ�⣮���ֱ������ձ��з���2.3���ƺ�0.1molþ������Ӧ��ȫ����ƽ���̣� ��
A.��ƽ��
B.ʢ�Ƶ�һ���³�
C.ʢþ��һ���³�
D.����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪п���仯����������������仯�������ơ���ͼ,������Ϊ��Һ��pH,������ΪZn2+��[Zn(OH)4]2-�����ʵ���Ũ��(����Zn2+Ũ��Ϊ10-5 mol��L-1ʱ,Zn2+�ѳ�����ȫ)������˵������ȷ����( )
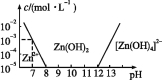
A����ZnCl2��Һ�м�����������������Һ�����ӷ���ʽΪZn2++4OH-![]() [Zn(OH)4]2-
[Zn(OH)4]2-
B����ͼ�����ݼ���ɵ�Zn(OH)2���ܶȻ�Ksp=10-17
C��ij��Һ�к�Zn2+,����Zn2+���Կ�����ҺpH�ķ�Χ��8~12
D����1 L 1 mol��L-1 ZnCl2��Һ�м���NaOH������pH=6����NaOH 2 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com