
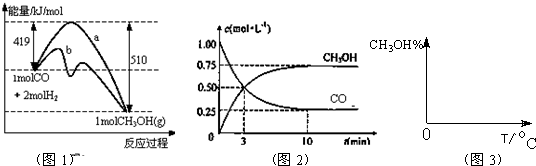
从能量的变化和反应的快慢等角度研究反应: 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
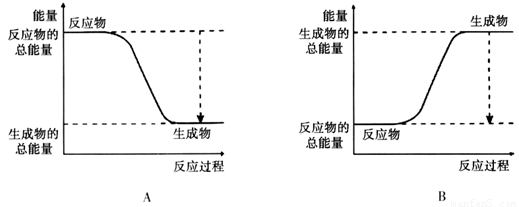
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
|
化学键 |
H—H |
O=O |
H—O |
|
键能 |
436 |
496 |
463 |
请填写下表:
|
化学键 |
填“吸收热量” 或“放出热量” |
能量变化 |
|
|
拆开化学键 |
|
_______________ |
_______________ |
|
|
|||
|
形成化学键 |
|
_______________ |
_______________ |
|
总能量变化 |
_______________ |
_______________ |
(4)氢氧燃料电池的总反应方程式为 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
(1)ABC (2)A
(3)
|
化学键 |
填“吸收”或“放出”能量 |
能量变化(kJ) |
|
|
拆开化学键 |
2molH2中的化学键 |
吸收热量 |
1368 |
|
1molO2中的化学键 |
|||
|
形成化学键 |
4molH-O键 |
放出热量 |
1852 |
|
总能量变化 |
放出热量 |
484 |
(4)负 氧化 2.24
【解析】
试题分析:(1)A、B、C均为增大反应速率的方法,D为减小反应速率。
(2)该反应为放热反应,反应物的总能量大于生成物的总能量。
(3)打破2molH2需要吸收2mol×436KJ/mol=872KJ;打破1molO2需要吸收1mol×496KJ/mol=496KJ
则共需要能量872KJ+496KJ=1368KJ能量;形成4molH-O键能够放出4mol×463KJ/mol=1852KJ;故总能量变化为1852KJ-1368KJ=484KJ。
(4)H2在反应中失去电子,为负极,发生氧化反应。 在燃料电池反应中,当电路转移0.2mol电子时,消耗0.1mol氢气,标况下,体积为2.24L。
考点:影响化学反应速率的因素,化学反应的能量变化计算以及燃料电池的基本知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
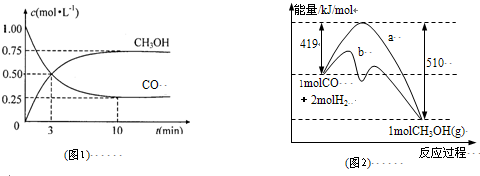
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ①温度升高,K值
①温度升高,K值查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省德宏州潞西市高三上学期期末统一测试化学试卷 题型:实验题
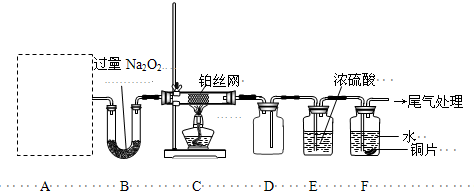
(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的 。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
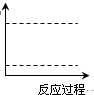
(4)请在如图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。

(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下体积为 L(忽略气体溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com