(2012?珠海一模)某化学研究性小组同学提出回收含铜电缆废料中提取铜的两种方案,并向专家咨询,专家就以下几个方面与同学们展开讨论:
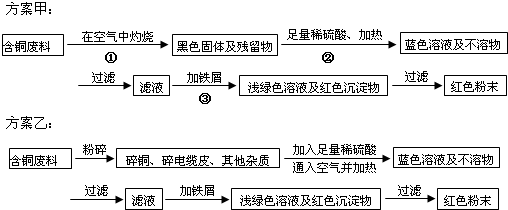
(1)两个方案哪个符合当前生产的绿色理念,为什么?
乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾
乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾
.
(2)方案甲中的②③步骤与铜有关的反应是离子反应吗?若是,写出离子方程式.
②CuO+2H+═Cu2++H2O③Fe+Cu2+═Fe2++Cu
②CuO+2H+═Cu2++H2O③Fe+Cu2+═Fe2++Cu
.
(3)专家建议,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,目的是:
确保Cu完全置换出来
确保Cu完全置换出来
.
(4)专家请同学们用简便的方法检验红色粉末中是否含有过量的铁屑,同学们运用所学的知识提出了几种方案,请你写出其中的一种方案.
可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生)
可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生)
.
(5)为了提高原料的利用率,专家建议把最后一步所得浅绿色滤液通过蒸发、冷却结晶、
过滤
过滤
、洗涤、自然干燥得到一种带结晶水的硫酸亚铁晶体.研究小组按专家的建议完成上面操作步骤,获得晶体后对其进行检测
①先取a g的晶体进行脱水实验,获得无水固体为(a-1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全.
研究小组通过计算测知该晶体的化学式是
FeSO4?7H2O
FeSO4?7H2O
.

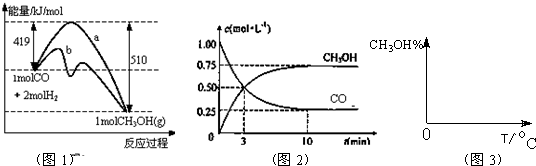
 CH3OH(g)
CH3OH(g) CH3OH(g)△H<0,则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
CH3OH(g)△H<0,则温度越高,逆向反应进行的程度越大,甲醇的含量就越低, ,故答案为:
,故答案为: