
| A. | NaOH | B. | Na2O2 | C. | 浓硫酸 | D. | 浓硝酸 |
分析 A.氢氧化钠容易潮解,并吸收二氧化碳;
B.过氧化钠与空气中水蒸气、二氧化碳反应,根据方程式判断;
C.浓硫酸具有吸水性.
D.浓硝酸易挥发分析;
解答 解:A.氢氧化钠易吸水潮解,并与二氧化碳反应而质量变大,故A错误;
B.过氧化钠与空气中水蒸气、二氧化碳反应,反应方程式为2Na2O2+2H2O═4NaOH+O2↑,2Na2O2+2CO2═2Na2CO3+O2↑,根据方程式可知反应后固体质量增大,故B错误;
C.浓硫酸具有吸水性,吸收空气 中水,溶液的质量增加,故C错误;
D.浓硝酸具有挥发性,硝酸分子挥发,溶质的质量减少,溶液的质量减小,故D正确;
故选:D.
点评 本题是对物质性质的考查,明确物质的性质是解题关键,注意基础知识的积累,题目难度不大.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
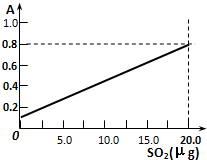 某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题:
某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题: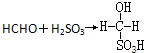
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y、Z的物质的量之比为1:2:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 容器中的压强不再发生变化 | |
| D. | 单位时间内生成n mol Z,同时生成2n mol Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1 L含CN-1.02 mg/L的废水,至少需要4.0×10-5mol 氯气处理后才符合排放标准 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸浓度越大,反应消耗的硝酸越少 | |
| B. | 硝酸浓度越大,产生的气体越少 | |
| C. | 硝酸浓度不同,生成Cu(NO3)2的物质的量不同 | |
| D. | 两者用排水法收集到气体体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
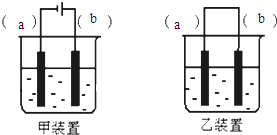 实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:
实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L HF气体分解成1L H2和1L F2吸收270KJ热量 | |
| B. | 1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270KJ | |
| C. | 在相同条件下1mol H2与1mol F2的能量总和大于2mol HF气体的能 | |
| D. | 1个氢分子与1个氟分子反应生成2个氟化氢分子放出279KJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com