
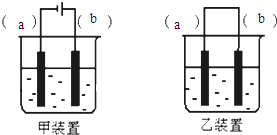
 实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:
实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:分析 (1)用煮沸的方法排出NaOH溶液中的氧气;
(2)由于铁与NaOH溶液不能发生自发的氧化还原反应,故不能设计成原电池,只能设计成电解池;
(3)在电解池中,要使铁能放电,铁应做阳极;
(4)由于铁做阳极,故Fe2+在阳极生成,则Fe(OH)2在阳极生成;
(5)要看到白色沉淀转化为红褐色沉淀的现象,只需让装置中有氧气生成即可.
解答 解:(1)由于Fe(OH)2有很强的还原性,故要想制得Fe(OH)2,必须排除装置和溶液中的氧气,而排出NaOH溶液中的氧气用煮沸的方法,故答案为:加热煮沸;
(2)原电池的反应必须是自发的氧化还原反应,而由于铁与NaOH溶液不能发生自发的氧化还原反应,故不能设计成原电池,只能设计成电解池,故答案为:甲;
(3)在电解池中,要使铁能放电变为Fe2+,铁应做阳极,即b为铁棒,阴极可以选择惰性电极,比如碳棒,即a为碳棒,故答案为:a-石墨;b-Fe;
(4)由于铁做阳极,则阳极上铁放电:Fe-2e-=Fe2+,故Fe2+在阳极生成,则Fe(OH)2在阳极生成,故答案为:阳极附近溶液中;
(5)要看到白色沉淀转化为红褐色沉淀的现象,只需让装置中有氧气生成即可,则只需让电极反向连接,则此时阳极为C棒,铁棒为阴极,则此时阳极上OH-放电生成氧气,会将Fe(OH)2氧化为Fe(OH)3,使白色沉淀转化为红褐色沉淀,故答案为:将电极反向连接.
点评 本题考查了Fe(OH)2的制取,应注意的是Fe(OH)2有很强的还原性,要防氧化,故采取加热煮沸以及加植物油等方法来防氧化.


 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:多选题
| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 控制工业废水的排放 | B. | 控制生活污水的排放 | ||
| C. | 对被污水污染了的河流进行治理 | D. | 减少用水量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2气体通入石蕊试液中,溶液先变红后褪色 | |
| B. | 在KI-淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 标准状况下,22.4 L任何气体中都含有6.02×1023个分子 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
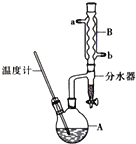 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下| 相对分 子质量 | 沸点/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com