
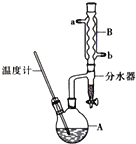
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下| 相对分 子质量 | 沸点/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. 分析 (1)根据浓硫酸的稀释操作,进行迁移解答;正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成CH3CH2CH2CH2OCH2CH2CH2CH3;
(2)采取逆流原理通入冷凝水进行充分冷却;
(3)用水可以溶解浓硫酸;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层;
(4)有机层中会残留NaOH及中和反应生成的盐Na2SO4,用水溶解除去;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,在分水器中会分层,密度小的在上层;
(7)根据正丁醇的质量计算正丁醚的理论产量,样品产率=(实际产量÷理论产量)×100%.
解答 解:(1)因为浓硫酸的密度大,应将浓硫酸加到正丁醇中,防止发生迸溅;
正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成CH3CH2CH2CH2OCH2CH2CH2CH3,反应方程式为:2CH3CH2CH2CH2OH  CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,
故答案为:将浓H2SO4滴加到正丁醇中;2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
(2)采取逆流原理通入冷凝水,使冷凝管充分冷凝水,进行充分冷却,即从b口通入冷凝水,
故答案为:b;
(3)用水可以洗去混有的浓H2SO4;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层,应从分液漏斗的上口分离出,
故答案为:浓H2SO4;上;
(4)步骤④中最后一次水洗,可以洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4,
故答案为:洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化,加热蒸馏时应收集142℃左右的馏分,
故答案为:d;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,密度小于水,在分水器中会分层,正丁醇在上层,水在下层,
故答案为:正丁醇;水;
(7)由2CH3CH2CH2CH2OH  CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,故样品产率为(11g÷32.5g)×100%=33.85%,
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,故样品产率为(11g÷32.5g)×100%=33.85%,
故答案为:33.85%.
点评 本题考查有机物的制备实验,侧重考查物质分离提纯、对原理与操作的分析评价、产率计算等,难度中等,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
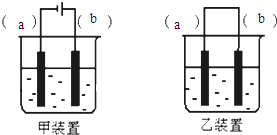 实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:
实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L HF气体分解成1L H2和1L F2吸收270KJ热量 | |
| B. | 1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270KJ | |
| C. | 在相同条件下1mol H2与1mol F2的能量总和大于2mol HF气体的能 | |
| D. | 1个氢分子与1个氟分子反应生成2个氟化氢分子放出279KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3含有的原子数为4NA | |
| B. | 78 g过氧化钠中含有的离子数为4NA | |
| C. | 过氧化钠与CO2反应生成32g O2,则反应转移的电子数为2NA | |
| D. | 密闭容器中,标准状况下22.4L SO2和11.2LO2 在加热、有催化剂的条件下充分反应,容器中的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
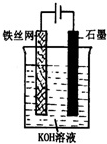
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
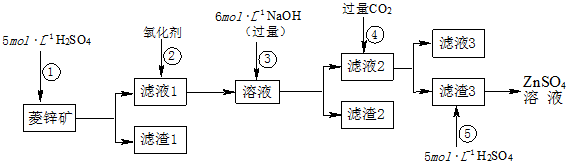
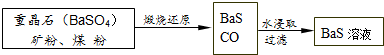
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液跟少量的饱和石灰水反应2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向氢氧化钠溶液中加入稀醋酸 OH-+H+═H2O | |
| C. | 向氯化铁溶液中加入铁粉 Fe+FeCl3=2Fe2++3Cl- | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验内容 | 结论 |
| A | 一红棕色气体能使湿润的KI-淀粉试纸变蓝 | 证明该红棕色气体一定为溴蒸气 |
| B | 向某溶液中加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 铝箔在酒精灯火焰上加热熔化但不滴落 | 说明铝箔表面氧化铝膜熔点高于铝 |
| D | 取少量待测晶体于试管中,加浓的NaOH溶液并加热,试管口湿润的红色石蕊试纸变蓝 | 证明晶体成分中含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com