
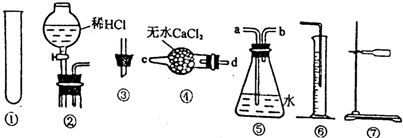
分析 测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积,可将固体混合物放入试管中加热,生成的二氧化碳气体用排水法测量体积;
(1)某Na2CO3样品的纯度(其中只含NaHCO3杂质),加热碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(2)实验装置中需要酒精灯加热;气体流向在装置④中应从d进c出,装置⑤是排水量气需要短进长出,b进a出;
(3)测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积,可将固体混合物放入试管中加热,生成的二氧化碳气体用排水法测量体积;测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积,应将固体放入试管中,将盐酸放入分液漏斗中,然后用排水法测量气体的体积;
(4)当实验一测得产生的二氧化碳为a L,当实验二测得产生的二氧化碳为bL,反应的相关方程式为,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,Na2CO3+2HCl═2NaCl+CO2↑+H2O,结合反应的方程式计算;
(5)二氧化碳与水反应生成弱电解质碳酸,碳酸能够部分电离出碳酸氢根离子,加入的碳酸氢钠能够抑制碳酸的电离,则减小了二氧化碳的损失;二氧化碳和碳酸钠溶液反应生成碳酸氢钠;
(6)⑥中液体的液面低于⑤中液体的液面,压强不平衡,待液面平衡后读取.
解答 解:(1)某Na2CO3样品的纯度(其中只含NaHCO3杂质),加热碳酸氢钠分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)反应应在加热条件下进行,实验中缺少酒精灯,实验装置中需要酒精灯加热;气体流向在装置④中应从d进c出,装置⑤是用排水法测量气体的体积时需要短进长出,b进a出,
故答案为:酒精灯;d;b;
(3)测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积,应将固体放入试管中,将盐酸放入分液漏斗中,然后用排水法测量气体的体积,应将实验一连接装置的顺序调整为将①装置换成②装置,
故答案为;将①装置换成②装置;
(4)当实验一测得产生的二氧化碳为a L,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
2 1 1
n $\frac{a}{22.4}$mol $\frac{a}{22.4}$mol
则:n=$\frac{a}{11.2}$mol,
则样品中NaHCO3的质量为:$\frac{a}{11.2}$mol×84g/mol=7.5ag;
当实验二测得产生的二氧化碳为b L,二氧化碳的物质的量为:$\frac{b}{22.4}$mol,
Na2CO3+2HCl═2NaCl+CO2↑+H2O,
根据分析可知,原混合物中碳酸氢钠分解后生成的碳酸钠的物质的量为 $\frac{a}{22.4}$mol,
设原混合物中含有xmolNa2CO3,
则:$\frac{a}{22.4}$+x=$\frac{b}{22.4}$,
整理可得:y=$\frac{b}{22.4}$-$\frac{a}{22.4}$,
则样品中碳酸钠的质量为:106($\frac{b}{22.4}$-$\frac{a}{22.4}$)g,NaHCO3的质量为:84g/mol×$\frac{a}{11.2}$mol=7.5ag,
则样品中碳酸钠纯度的实验值为=$\frac{106(\frac{b}{22.4}-\frac{a}{22.4})g}{106(\frac{b}{22.4}-\frac{a}{22.4})g+7.5ag}$×100%=$\frac{106(b-a)}{106b+62a}$×100%,
故答案为:7.5ag;$\frac{106(b-a)}{106b+62a}$×100%;
(5)由于CO2与水反应生成碳酸,碳酸能够电离出碳酸氢根离子和氢离子:CO2+H2O?H2CO3?HCO3-+H+,而NaHCO3电离产生的HCO3-能使上述平衡向着逆向移动,减少了CO2的损失;
不能将⑤中的水改用Na2CO3饱和溶液是因为二氧化碳和碳酸钠溶液反应生成碳酸氢钠,反应的离子方程式为:CO32-+CO2+H2O═2HCO3-,
故答案为:因为CO2与水反应,CO2+H2O?H2CO3?HCO3-+H+,NaHCO3电离产生的HCO3-能使上述平衡逆移,减少了CO2的损失;CO32-+CO2+H2O═2HCO3-;
(6)实验一读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,压强不平衡,待液面平衡后读取,此时读取a值偏小,故答案为:偏小.
点评 本题考查物质的含量测定,为高考常见题型,题目难度较大,明确实验目的为解答关键,试题侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和实验装置的连接顺序.


科目:高中化学 来源: 题型:多选题
| A. | 控制工业废水的排放 | B. | 控制生活污水的排放 | ||
| C. | 对被污水污染了的河流进行治理 | D. | 减少用水量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2气体通入石蕊试液中,溶液先变红后褪色 | |
| B. | 在KI-淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 标准状况下,22.4 L任何气体中都含有6.02×1023个分子 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol Fe溶解于一定量的HN03溶液中,电子转移数介于2NA和3NA间 | |
| B. | L mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个Fe(OH)3胶粒 | |
| C. | 0.01 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| D. | 10 mL 5mol/L (NH4)2S04溶液中含有NH4+数目为0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气 | |
| B. | 过氧化钡的化学式是Ba2O2 | |
| C. | 过氧化钡是离子化合物 | |
| D. | 过氧化钠和过氧化钡都是强氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为置换反应 | B. | 每生成1mol O2转移4mol e- | ||
| C. | H2O2被还原 | D. | 反应后溶液pH值升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
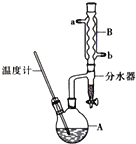 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下| 相对分 子质量 | 沸点/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氢钠溶液中加入盐酸:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com