
| A. | 8g | B. | 0.8g | C. | 1.6g | D. | 16g |
科目:高中化学 来源: 题型:选择题
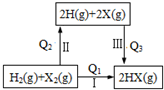
| A. | Q3>0 | B. | Q1=Q2+Q3 | ||
| C. | 按Cl、Br、I的顺序,Q2依次增大 | D. | Q1越大,HX越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物都是金属氧化物 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | NaO2能与酸反应生成盐和水,所以 NaO2是碱性氧化物 | |
| D. | SiO2 既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别放在炒锅中加热,观察是否有残留物 | |
| B. | 分别用干净铁丝蘸取样品在燃气炉的火焰上灼烧,观察火焰颜色 | |
| C. | 在水杯中各盛少许相同质量的样品,分别加入足量的水,观察样品是否溶解 | |
| D. | 在水杯中各盛少许相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片粉与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氧化亚铁粉末溶于盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铜与氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 向硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③④⑤ | C. | ③④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com