
【题目】下列关于有机化合物的说法正确的是 ( )
A. ![]() 有3种官能团
有3种官能团
B. 三元轴烯(![]() )与苯互为同分异构体
)与苯互为同分异构体
C. 乙苯分子中最多有7个碳原子在同一平面上
D. 烷烃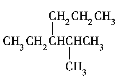 的正确命名是2甲基3丙基戊烷
的正确命名是2甲基3丙基戊烷
科目:高中化学 来源: 题型:
【题目】(1)写出除杂所用试剂及方法(括号里面是杂质)
①溴苯(溴) 试剂__________;方法_____;
②乙烷(乙烯)试剂___;方法____;
(2)某有机物的结构简式如图所示,若等物质的量的该有机物分别与足量Na、NaOH、NaHCO3恰好反应时,则消耗Na、NaOH、NaHCO3的物质的量之比是__________。
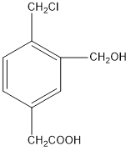
(3)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。 16.8 g该有机物经燃烧生成44.0 gCO2和14.4 gH2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有-O-H键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积比为6:1:1。
①A的分子式是______ ; A的结构简式是_______;
②有机物B是A的同分异构体,1 mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。B的结构简式是_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_________;正极的电极反应式为__________________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,电池工作时,b极的电极名称为_______;负极的电极反应式为____________;

②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 + Pb+ 2H2SO4 === PbSO4 + 2H2O,铅蓄电池负极的电极反应式为__________;充电时,铅蓄电池的PbO2极应与外加直流电源的__极相连,PbO2极的电极反应式为_________。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应质)时,以硫酸铜溶液为电解质溶液,粗铜做_____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 氯乙烯、聚乙烯、苯乙烯都是不饱和烃
B. 化合物![]() 不是苯的同系物
不是苯的同系物
C. 甲苯与氢气完全加成后,再发生氯代反应,其一氯代物的同分异构体数目有4种
D. ![]() 分子中所有碳原子一定共平面
分子中所有碳原子一定共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Cl-的物质的量浓度最大的是( )
A.75mL4mol/L的KClO3溶液
B.50mLAl3+浓度为1mol/L的AlCl3溶液
C.9.5gMgCl2溶于水所配得的100mL溶液
D.1L密度为1.1g/cm3、质量分数为3.65%的HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国云南东川铜矿富含辉铜矿(主要成分Cu2S),因含铜成分高而成为重要的炼铜原料。资料表明,当蓝矾溶液渗入地下遇硫铁矿(主要成分:二硫化亚铁FeS2)时,可生成辉铜矿Cu2S,其化学方程式为:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。硫铁矿也是一种重要化工原料,其主要成分可在沸腾炉中鼓入空气高温煅烧生成Fe2O3和一种对环境有污染的有毒气体,回答下列问题:
(1)在化合物FeS2和Cu2S中,硫元素的化合价分别为__、__。
(2)在上述生成辉铜矿的反应中,氧化剂与还原剂的物质的量之比为__。由题中信息可推知Cu2S的溶解情况是:__溶于水(填“不”或“能”,下同),__溶于稀硫酸。
(3)写出硫铁矿的主要成分鼓入空气高温煅烧的化学方程式:__,若反应中有2.2mol电子发生转移时,可生成标准状况下的有毒气体的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.10 mol·L-1的NaOH溶液,整个过程中溶液pH变化的曲线如图所示。下列叙述中正确的是

A. 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. 点②所示溶液中:c(H+)>c(Cl-)>c(ClO—)>c(HClO)
C. 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用来鉴别Na2CO3和NaHCO3两种物质的实验方法是( )
A. 分别加热这两种固体物质,并将产生气体通入Ca(OH)2溶液
B. 分别加入同浓度的稀HCl
C. 分别加入Ca(OH)2溶液
D. 分别加入CaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲基砜是合成人体胶原蛋白的必要物质。实验室用二甲基硫醚为原料合成二甲基砜的新方法为:
反应 i:(CH3)2S+H2O2→(CH3)2SO+H2O
反应 ii: 。
二甲基硫醚(CH3)2S | 二甲基亚枫(CH3)2SO | 二甲基砜(CH3)2SO2 | |
密度 | 0.85 g·cm-3 | 1.10 g·cm-3 | —— |
熔点/沸点 | -83.2℃/37.5℃ | 18.4℃/189℃ | 111℃/238℃ |
溶解性 | 不溶于水 | 易溶于水、乙醇 | 易溶于水、乙醇 |
具体流程如下:
![]()
回答下列问题:
(1)反应装置如图所示,仪器 B 的名称是_____,其作用是_____。
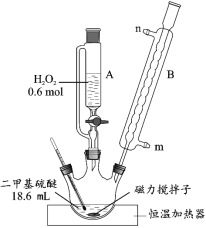
(2)第①步反应温度不高于 40 ℃的原因是_____;该步骤反应完全的现象是_____。
(3)第②步先将 A 中滴加剩余的 H2O2 全部加入三颈烧瓶中,然后加热发生反应 ii。该反应的化学方程式为_____。
(4)第③步的实验操作为_____、过滤、低温干燥,得到二甲基砜产品。
(5)二甲基砜传统的生产工艺是由 HNO3 氧化(CH3)2S 生成(CH3)2SO,然后用 NaOH 中和、精馏,制得精品(CH3)2SO,最后再经氧化制得(CH3)2SO2。该新方法与传统硝酸氧化法比的优点有_____(至少回答 2 点)。
(6)该实验中制得二甲基砜 19.176g。二甲基砜的产率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com