
【题目】我国云南东川铜矿富含辉铜矿(主要成分Cu2S),因含铜成分高而成为重要的炼铜原料。资料表明,当蓝矾溶液渗入地下遇硫铁矿(主要成分:二硫化亚铁FeS2)时,可生成辉铜矿Cu2S,其化学方程式为:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。硫铁矿也是一种重要化工原料,其主要成分可在沸腾炉中鼓入空气高温煅烧生成Fe2O3和一种对环境有污染的有毒气体,回答下列问题:
(1)在化合物FeS2和Cu2S中,硫元素的化合价分别为__、__。
(2)在上述生成辉铜矿的反应中,氧化剂与还原剂的物质的量之比为__。由题中信息可推知Cu2S的溶解情况是:__溶于水(填“不”或“能”,下同),__溶于稀硫酸。
(3)写出硫铁矿的主要成分鼓入空气高温煅烧的化学方程式:__,若反应中有2.2mol电子发生转移时,可生成标准状况下的有毒气体的体积为__L。
【答案】-1 -2 35:3 不 不 4FeS2+11O2![]() 2Fe2O3+8SO2 8.96
2Fe2O3+8SO2 8.96
【解析】
![]() 该反应中铜和7个负一价硫的化合价降低,3个负一价硫的化合价升高。
该反应中铜和7个负一价硫的化合价降低,3个负一价硫的化合价升高。
(1)![]() (二硫化亚铁)中铁为+2价,硫为-1价;
(二硫化亚铁)中铁为+2价,硫为-1价;![]() (硫化亚铜)中铜为+1价,硫为-2价,
(硫化亚铜)中铜为+1价,硫为-2价,
故答案为:-1;-2;
(2)![]() 该反应中铜和7个负一价硫的化合价降低,即14个硫酸铜和3.5个
该反应中铜和7个负一价硫的化合价降低,即14个硫酸铜和3.5个![]() 做氧化剂,3个负一价硫的化合价升高,即1.5个
做氧化剂,3个负一价硫的化合价升高,即1.5个![]() 做还原剂,故氧化剂与还原剂的物质的量之比为35:3;根据反应
做还原剂,故氧化剂与还原剂的物质的量之比为35:3;根据反应![]() 及题目信息,可知
及题目信息,可知![]() 不溶于水,也不溶于稀硫酸,
不溶于水,也不溶于稀硫酸,
故答案为:35:3;不;不;
(3)根据题目信息‘硫铁矿可在沸腾炉中鼓入空气高温煅烧生成![]() 和一种对环境有污染的有毒气体’,可推知
和一种对环境有污染的有毒气体’,可推知![]() 和氧气反应生成
和氧气反应生成![]() 和二氧化硫,方程式为:
和二氧化硫,方程式为: ,该反应转移电子数为44,即转移44个电子生成8个二氧化硫,故当转移2.2mol电子时,生成0.4mol二氧化硫,标况下体积为:8.96L,
,该反应转移电子数为44,即转移44个电子生成8个二氧化硫,故当转移2.2mol电子时,生成0.4mol二氧化硫,标况下体积为:8.96L,
故答案为: ;8.96。
;8.96。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取 0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:_______________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=________
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=________ mol·L-1,c(OH-)-c(HA)=________ mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH____7(填“>”、“<”或“=”)。
(5)将同温度下等浓度的三种盐溶液按pH由大到小的顺序排列是________(填序号)。
a.NH4HCO3 b.NH4A c. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+ |
可能大量含有的阴离子 | Cl-、CO32- |
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)
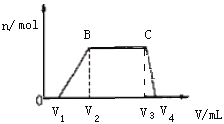
(1)该溶液中一定不含有的离子是___。
(2)V1、V2、V3、V4之间的关系___。
(3)V3V4段离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是 ( )
A. ![]() 有3种官能团
有3种官能团
B. 三元轴烯(![]() )与苯互为同分异构体
)与苯互为同分异构体
C. 乙苯分子中最多有7个碳原子在同一平面上
D. 烷烃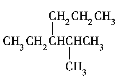 的正确命名是2甲基3丙基戊烷
的正确命名是2甲基3丙基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

(1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→________________→B;为使NH3与Cl2更充分混合,Cl2应从C装置的__口进入(填“x”或“y”).
(2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是__________________.
(3)装置A中发生反应的离子方程式为_______________________________.
(4)装置B中圆底烧瓶内的试剂为______________(填名称).
(5)装置D的作用是____________________________.
(6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480mL1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
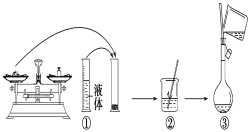
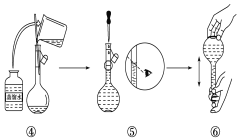
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有____。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是____(填操作序号)。
(3)称取NaOH固体时,所需砝码的质量为____(填写字母)。
A. 19.2g B. 20g C. 19.2g ~20g D. 大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号)___ 。
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是____。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量水滴
(6)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
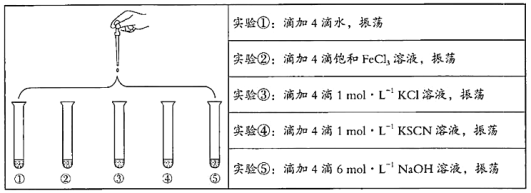
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com