
【题目】常温下,如果取 0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:_______________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=________
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=________ mol·L-1,c(OH-)-c(HA)=________ mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH____7(填“>”、“<”或“=”)。
(5)将同温度下等浓度的三种盐溶液按pH由大到小的顺序排列是________(填序号)。
a.NH4HCO3 b.NH4A c. NH4Cl
【答案】A-+H2O![]() HA+OH- 10-6 mol/L 0.99×10-6 10-8 > a>b>c
HA+OH- 10-6 mol/L 0.99×10-6 10-8 > a>b>c
【解析】
。
(1)常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐;
(2)根据混合溶液中水电离出的c(OH-)=![]() 计算;
计算;
(3)根据溶液中存在的电荷守恒、质子守恒分析计算;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,据此判断(NH4)2CO3溶液酸碱性,据此分析解答(4)~(5)。
常温下,0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好完全反应生成NaA,混合溶液的pH=8,呈碱性,说明NaA为强碱弱酸盐,则HA为弱酸。
(1)NaA为强碱弱酸盐,A-水解导致NaA溶液呈碱性,水解方程式为A-+H2OHA+OH-,故答案为:A-+H2OHA+OH-;
(2)混合溶液的pH=8,混合溶液中水电离出的c(OH-)=![]() =
=![]() mol/L=10-6mol/L,故答案为:10-6mol/L;
mol/L=10-6mol/L,故答案为:10-6mol/L;
(3)溶液中存在电荷守恒,根据电荷守恒得c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L =0.99×10-6mol/L;根据质子守恒有c(HA)+c(H+)=c(OH-),则c(OH-)-c(HA)=c(H+)=10-8mol/L,故答案为:0.99×10-6 ;10-8;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,即HA电离程度大于碳酸,所以铵根离子水解程度小于碳酸根离子,溶液呈碱性,则pH>7,故答案为:>;
(5)NH4Cl为强酸弱碱盐,水解后溶液显酸性;NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,因此(NH4)2CO3溶液显碱性,则同温度下等浓度的三种盐溶液按pH由大到小的顺序排列顺序为a>b>c,故答案为:a>b>c。


科目:高中化学 来源: 题型:
【题目】SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是__(填元素符号),电负性最大的是__(填元素符号)。
(2)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道。
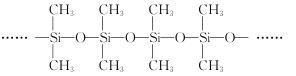
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为__。以甲基硅油为主要成分的硅橡胶能够耐高温的原因是__。
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为__,其含有的共价键类型有__。
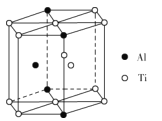
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为__。其结构单元棱长为apm,底面边长为bpm,该合金的密度为___g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
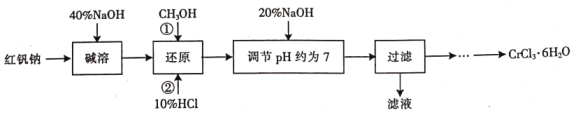
【题目】氯化铬晶体![]() 是一种重要的工业原料,工业上常用铬酸钠
是一种重要的工业原料,工业上常用铬酸钠![]() 来制备。实验室中以红矾钠
来制备。实验室中以红矾钠![]() 为原料制备
为原料制备![]() 的流程如下:
的流程如下:
已知:①![]() ;
;
②![]() 不溶于乙醚,易溶于水、乙醇,易水解;
不溶于乙醚,易溶于水、乙醇,易水解;
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是________________。
(2)还原时先加入过量![]() 再加入10%HCl,生成
再加入10%HCl,生成![]() ,该反应的离子方程式为________________。
,该反应的离子方程式为________________。
(3)用蒸馏法从滤液中分离出![]() 循环使用。
循环使用。
①下列有关蒸馏实验说法正确的是_________(填序号)。
A.蒸馏开始,应先加热再通冷凝水
B.通过蒸馏可除去液体中难挥发或不挥发的杂质
C.若温度计插入混合液中,则会收集到沸点偏高的杂质
D.当蒸馏沸点过高的成分时,应用空气冷凝
②实验设计用下图装置进行蒸馏,该装置中存在的错误有_________。
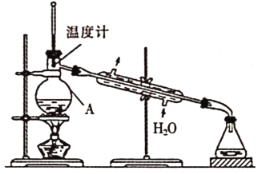
③在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的![]() 。有的同学认为,该过程中需要加入CaO,防止水随
。有的同学认为,该过程中需要加入CaO,防止水随![]() 一起蒸出,你认为是否有必要并说明理由:_______。
一起蒸出,你认为是否有必要并说明理由:_______。
(4)请补充完整由过滤后得到的固体![]() 制备
制备![]() 的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体__________,__________,冷却结晶,过滤,__________,低温干燥,得到
的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体__________,__________,冷却结晶,过滤,__________,低温干燥,得到![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如图,下列说法错误的是( )
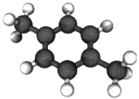
A.“PX”的分子式为C8H10
B.“PX”难溶于水,易溶于四氯化碳
C.“PX”分子中,最多有14个原子共面
D.“PX”的二氯代物共有6种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_________;正极的电极反应式为__________________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,电池工作时,b极的电极名称为_______;负极的电极反应式为____________;

②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 + Pb+ 2H2SO4 === PbSO4 + 2H2O,铅蓄电池负极的电极反应式为__________;充电时,铅蓄电池的PbO2极应与外加直流电源的__极相连,PbO2极的电极反应式为_________。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应质)时,以硫酸铜溶液为电解质溶液,粗铜做_____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液中离子浓度大小顺序为____________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=____________。
(3)已知纯水中存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
a.向水中加入NaHSO4固体
b.向水中加Na2CO3固体
c.加热至100 ℃其中c(H+)=1×10-6 mol·L-1
d.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 氯乙烯、聚乙烯、苯乙烯都是不饱和烃
B. 化合物![]() 不是苯的同系物
不是苯的同系物
C. 甲苯与氢气完全加成后,再发生氯代反应,其一氯代物的同分异构体数目有4种
D. ![]() 分子中所有碳原子一定共平面
分子中所有碳原子一定共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国云南东川铜矿富含辉铜矿(主要成分Cu2S),因含铜成分高而成为重要的炼铜原料。资料表明,当蓝矾溶液渗入地下遇硫铁矿(主要成分:二硫化亚铁FeS2)时,可生成辉铜矿Cu2S,其化学方程式为:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。硫铁矿也是一种重要化工原料,其主要成分可在沸腾炉中鼓入空气高温煅烧生成Fe2O3和一种对环境有污染的有毒气体,回答下列问题:
(1)在化合物FeS2和Cu2S中,硫元素的化合价分别为__、__。
(2)在上述生成辉铜矿的反应中,氧化剂与还原剂的物质的量之比为__。由题中信息可推知Cu2S的溶解情况是:__溶于水(填“不”或“能”,下同),__溶于稀硫酸。
(3)写出硫铁矿的主要成分鼓入空气高温煅烧的化学方程式:__,若反应中有2.2mol电子发生转移时,可生成标准状况下的有毒气体的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | SO2缓慢通入滴有酚酞的NaOH溶液中,溶液红色褪去 | SO2具有漂白性 |
B | 将充满NO2的密闭玻璃球浸泡在热水中,气体红棕色加深 | 2NO2(g) |
C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
D | 向2支均盛有2mL相同浓度Na3[Ag(S2O3)2]溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com