
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液中离子浓度大小顺序为____________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=____________。
(3)已知纯水中存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
a.向水中加入NaHSO4固体
b.向水中加Na2CO3固体
c.加热至100 ℃其中c(H+)=1×10-6 mol·L-1
d.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
【答案】c(Cl-)>c(NH4+)>c(H+)>c(OH-) 10-3 mol·L-1 10-11 mol·L-1 d <
【解析】
(1)NH4Cl为强酸弱碱盐,铵根离子水解呈酸性;
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸电离抑制水的电离;
(3)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离,据此分析解答。
(1)氯化铵为强酸弱碱盐,水解后溶液呈酸性,铵根离子水解的离子方程式为NH4++H2OH++NH3H2O,铵根离子水解,则c(Cl-)>c(NH4+),所以溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(OH-)=10-3mol/L,c(H+)=![]() mol/L=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L,故答案为:10-3mol/L;10-11mol/L;
mol/L=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L,故答案为:10-3mol/L;10-11mol/L;
(3)a.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,H2O![]() H++OH-平衡向左移动,故a错误;b.向水中加Na2CO3固体,水解后溶液呈碱性,故b错误;c.加热至100℃,促进水的电离,溶液呈中性,故c错误;d.向水中加入(NH4)2SO4固体,铵根离子水解,促进水的电离,H2O
H++OH-平衡向左移动,故a错误;b.向水中加Na2CO3固体,水解后溶液呈碱性,故b错误;c.加热至100℃,促进水的电离,溶液呈中性,故c错误;d.向水中加入(NH4)2SO4固体,铵根离子水解,促进水的电离,H2O![]() H++OH-平衡向右移动,溶液呈酸性,故d正确;故答案为:d;
H++OH-平衡向右移动,溶液呈酸性,故d正确;故答案为:d;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水进行稀释,故答案为:<。


科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是
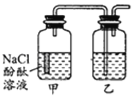
A. 乙中导气管里形成一段水柱B. 乙中导气管中产生气泡
C. 金属片剪口处溶液变红D. 锌被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 0.10 mol·L1一元弱碱MOH溶液中滴入0.10 mol·L1的盐酸,溶液的AG与所加盐酸的体积关系如图所示,已知AG = lg ![]() 。
。
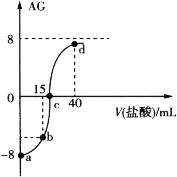
下列有关叙述不正确的是( )
A.50℃下,AG=0,此时溶液显中性
B.a点对应溶液中H2O电离出的c(H+)=1.0×1011 mol·L1
C.b点对应溶液中 4c(M+)+4c(MOH)=3c(Cl)
D.d点对应溶液中c(Cl)>c(H+)> c(M+)>c(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取 0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:_______________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=________
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=________ mol·L-1,c(OH-)-c(HA)=________ mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH____7(填“>”、“<”或“=”)。
(5)将同温度下等浓度的三种盐溶液按pH由大到小的顺序排列是________(填序号)。
a.NH4HCO3 b.NH4A c. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①分液漏斗②量筒③容量瓶,使用前需检查是否漏液的是___(填序号)
(2)___molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)标准状况下的四种气体:①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是___(填序号)
(4)10mL的CaCl2溶液里含2gCa2+,从中取出一半的溶液中Cl-的物质的量浓度是___。
(5)在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,a和b的关系是___。
(6)某物质A加热时按化学方程式2A=2B+C+3D分解,产物均为气体,测得由生成物组成的混合气体对H2的相对密度为20,则反应物A的摩尔质量为___。
(7)下列物质中:①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠。
属于电解质的是___, 非电解质的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+ |
可能大量含有的阴离子 | Cl-、CO32- |
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)
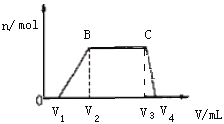
(1)该溶液中一定不含有的离子是___。
(2)V1、V2、V3、V4之间的关系___。
(3)V3V4段离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯代烃中不能由烯烃与氯化氢加成直接得到的有( )
A. 2一乙基—4—氯—1—丁烯 B. 氯代环己烷
C. 2,2,3,3—四甲基—1—氯丁烷 D. 3一甲基—3—氯戊烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com