
【题目】(1)有①分液漏斗②量筒③容量瓶,使用前需检查是否漏液的是___(填序号)
(2)___molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)标准状况下的四种气体:①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是___(填序号)
(4)10mL的CaCl2溶液里含2gCa2+,从中取出一半的溶液中Cl-的物质的量浓度是___。
(5)在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,a和b的关系是___。
(6)某物质A加热时按化学方程式2A=2B+C+3D分解,产物均为气体,测得由生成物组成的混合气体对H2的相对密度为20,则反应物A的摩尔质量为___。
(7)下列物质中:①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠。
属于电解质的是___, 非电解质的是___。
【答案】①③ 3 ② 10mol/L 2a-b=0.2 120g/mol ②⑦⑧ ③⑥
【解析】
(1)若分液漏斗漏液,则会导致使用时液体沿漏斗颈流出;若容量瓶瓶塞与瓶口间漏液,则会造成定容时有液体流出。
(2)利用O原子守恒,则n(H2O)= 1.5mol×2,从而求出n(H2O)。
(3)标准状况下,气体的密度之比等于其相对分子质量之比,比较四种气体的相对分子质量,即可确定密度最大的气体。
(4)c(Cl-)=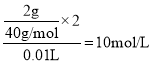 ,从中取出一半的溶液中Cl-的物质的量浓度不变。
,从中取出一半的溶液中Cl-的物质的量浓度不变。
(5)利用电荷守恒,可求出a和b的关系。
(6)由生成物组成的混合气体对H2的相对密度为20,则生成物的平均相对分子质量为20×2=40,可假设反应物为2mol,则生成物为6mol,利用分解前后质量相等建立等量关系式,从而求出反应物A的摩尔质量。
(7)属于电解质的是酸、碱、盐, 属于非电解质的是非金属氧化物和氮的氢化物。
(1)分液漏斗的活塞处,容量瓶的瓶塞与瓶口处都可能漏液,所以需检查是否漏液的仪器是①③。答案为:①③;
(2)利用O原子守恒,n(H2O)= 1.5mol×2,则n(H2O)=3mol。答案为:3;
(3)标准状况下,气体的密度之比等于其相对分子质量之比,四种气体的相对分子质量分别为①CH4,16,②HCl,36.5,③H2S,34,④NH3,17。HCl的相对分子质量最大,即可确定密度最大的气体是②。答案为:②;
(4)10mL的CaCl2溶液里含2gCa2+,c(Cl-)=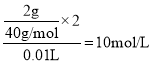 ,从中取出一半的溶液中Cl-的物质的量浓度仍为10mol/L。答案为:10mol/L;
,从中取出一半的溶液中Cl-的物质的量浓度仍为10mol/L。答案为:10mol/L;
(5)在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,利用电荷守恒,可得出2a=0.2+b。答案为:2a-b=0.2;
(6)由生成物组成的混合气体对H2的相对密度为20,则生成物的平均相对分子质量为20×2=40,可假设反应物为2mol,则生成物为6mol,利用质量守恒可得出2mol×M(A)=6mol×40g/mol,从而求出M(A)= 120g/mol。答案为:120g/mol;
(7)在①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠中,②⑦⑧都是纯净的盐,属于电解质;③⑥为纯净的非金属氧化物和氮的氢化物,属于非电解质。答案为:②⑦⑧;③⑥。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量______;
②若B、C都不是气体,气体的平均相对分子质量______;
③若B是气体,C不是气体,气体的平均相对分子质量______;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是__________态,C的状态是__________态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2![]() N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL:
(1)配制时,必须使用的玻璃仪器有胶头滴管、烧杯、玻璃棒、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液中离子浓度大小顺序为____________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=____________。
(3)已知纯水中存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
a.向水中加入NaHSO4固体
b.向水中加Na2CO3固体
c.加热至100 ℃其中c(H+)=1×10-6 mol·L-1
d.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一。也是国家的战略储备药物。也有专家尝试使用奥司他韦作为抗新型冠状病毒(2019-nCoV)药物。以莽草酸作为起始原料是合成奥司他韦的主流路线。
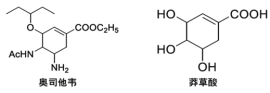
Ⅰ.莽草酸是从中药八角茴香中提取的一种化合物,是合成奥司他韦的原料。下列有关莽草酸说法正确的是__
A 不能使酸性高锰酸钾溶液褪色
B 可以发生加成反应、消去反应、加聚反应、缩聚反应、取代反应
C 分子中所有原子共平面
D 只溶于苯等有机溶剂,不溶于水
Ⅱ.奥司他韦的合成路线如下:
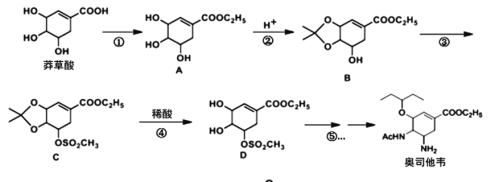
已知:![]()
回答下列问题:
(1)化合物A的含氧官能团名称有:_______,反应③的反应类型:____。
(2)反应①的反应试剂和反应条件:____。
(3)请写出反应②的化学方程式:____。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有__种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有__个手性碳。
(6)结合以上合成路线设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线____。
的合成路线____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物遇硝酸银溶液产生白色沉淀
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。
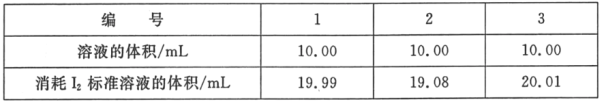
①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com