
【题目】下列氯代烃中不能由烯烃与氯化氢加成直接得到的有( )
A. 2一乙基—4—氯—1—丁烯 B. 氯代环己烷
C. 2,2,3,3—四甲基—1—氯丁烷 D. 3一甲基—3—氯戊烷
【答案】C
【解析】
本题考查加成反应。A.2一乙基—4—氯—1—丁烯可由CH2=C(CH2CH3)CH=CH2与氯化氢加成直接得到;B.氯代环己烷环己烯![]() 与氯化氢加成直接得到;C.2,2,3,3—四甲基—1—氯丁烷没有对应烯烃,不能由烯烃与氯化氢加成直接得到;D.3一甲基—3—氯戊烷可由2—戊烯CH3CH=CHCH2CH3与氯化氢加成直接得到。
与氯化氢加成直接得到;C.2,2,3,3—四甲基—1—氯丁烷没有对应烯烃,不能由烯烃与氯化氢加成直接得到;D.3一甲基—3—氯戊烷可由2—戊烯CH3CH=CHCH2CH3与氯化氢加成直接得到。
2一乙基-4-氯-1-丁烯的结构简式为CH2=C(CH2CH3)CH2CH2Cl,可由CH2=C(CH2CH3)
CH=CH2与氯化氢加成直接得到,A不选;氯代环己烷的结构简式为 ,可由环己烯
,可由环己烯![]() 与氯化氢加成直接得到,B不选;2,2,3,3—四甲基—1—氯丁烷的结构简式为(CH3)3CC(CH3)2CH2Cl,没有对应烯烃,则不能由烯烃与氯化氢加成直接得到,C选;3一甲基—3—氯戊烷的结构简式为CH3CH2CH(Cl)CH2CH3,可由2—戊烯CH3CH=CHCH2CH3与氯化氢加成直接得到,D不选。
与氯化氢加成直接得到,B不选;2,2,3,3—四甲基—1—氯丁烷的结构简式为(CH3)3CC(CH3)2CH2Cl,没有对应烯烃,则不能由烯烃与氯化氢加成直接得到,C选;3一甲基—3—氯戊烷的结构简式为CH3CH2CH(Cl)CH2CH3,可由2—戊烯CH3CH=CHCH2CH3与氯化氢加成直接得到,D不选。
故选C。


科目:高中化学 来源: 题型:
【题目】某地湖盐中含有![]() 等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:
等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:
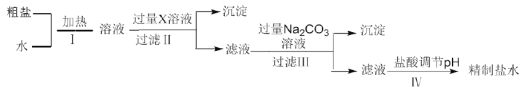
(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去![]() ,加入的X溶液是__________。
,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100g![]() ]
]
|
|
|
|
|
|
|
|
|
|
|
|
①过程Ⅲ中生成的主要沉淀除![]() 和
和![]() 外还有__________。
外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的![]() ,除去这些离子及进行电解的流程如下:
,除去这些离子及进行电解的流程如下:
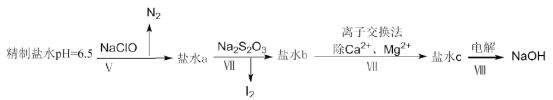
①过程Ⅴ生成![]() 的离子方程式为__________。
的离子方程式为__________。
②过程Ⅳ可以通过控制![]() 的量,将
的量,将![]() 还原为
还原为![]() ,且盐水b中含有
,且盐水b中含有![]() ,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的![]() 俗称海波,是一种重要的化工原料。商品海波主要成分是
俗称海波,是一种重要的化工原料。商品海波主要成分是![]() .为了测定其含
.为了测定其含![]() 的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为
的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为![]() 的碘水滴定(发生反应
的碘水滴定(发生反应![]() ),下表记录滴定结果:
),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
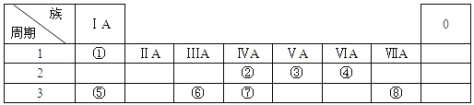
(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程___________
(2)④、②元素形成的化合物的结构式__________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____
(4)⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________
(5)由①③⑧组成的M 物质中所含化学键的类型_________________
(6)M中的阳离子的鉴定方法是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池的正极的反应式_________。
(2)由 Mg、Al和氢氧化钠溶液组成的原电池中,负极的反应式 ________。当在电极上产生气体3.36L(标准状况)时,导线中通过的电子电子数目为_____个(用 NA表示阿伏加德罗常数的值)。
(3)日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池结构如下图所示,据此回答下列问题:
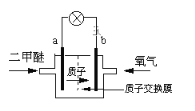
a极为电池的____极,b电极上的电极反应式为____。电池工作时电流的方向是由_______(填“a”或“b”, 下同)经导向______。电池工作时,若有0.1mol二甲醚被氧化时,有_______mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于250 mL容量瓶中,加入蒸馏水溶解,定容至刻度线即可。 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
D | 制备Fe(OH)3胶体 | 通常是将Fe(OH)3固体溶于热水中即可 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用Fe2O3、Cu2O的混合物制取较纯净的胆矾(CuSO4·5H2O),实验方案如图所示
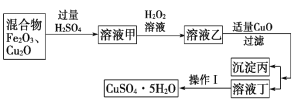
(1)稀硫酸溶解混合物时发生反应的离子方程式为Cu2O+2H+===Cu+Cu2++H2O、_________________________。
(2)加H2O2的目的是_______________,其反应的离子方程式为________________。
(3)溶液乙中加入适量CuO时发生反应的离子方程式为_________________。
(4)操作Ⅰ主要包括________、________、过滤、洗涤、晾干等步骤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
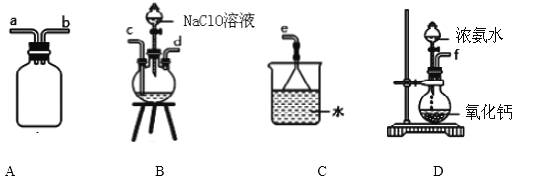
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com