
【题目】某地湖盐中含有![]() 等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:
等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:
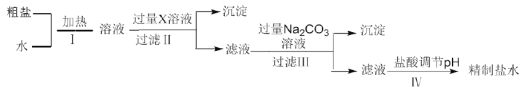
(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去![]() ,加入的X溶液是__________。
,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100g![]() ]
]
|
|
|
|
|
|
|
|
|
|
|
|
①过程Ⅲ中生成的主要沉淀除![]() 和
和![]() 外还有__________。
外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的![]() ,除去这些离子及进行电解的流程如下:
,除去这些离子及进行电解的流程如下:
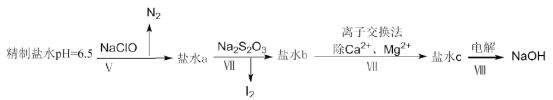
①过程Ⅴ生成![]() 的离子方程式为__________。
的离子方程式为__________。
②过程Ⅳ可以通过控制![]() 的量,将
的量,将![]() 还原为
还原为![]() ,且盐水b中含有
,且盐水b中含有![]() ,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的![]() 俗称海波,是一种重要的化工原料。商品海波主要成分是
俗称海波,是一种重要的化工原料。商品海波主要成分是![]() .为了测定其含
.为了测定其含![]() 的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为
的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为![]() 的碘水滴定(发生反应
的碘水滴定(发生反应![]() ),下表记录滴定结果:
),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
【答案】加快物质溶解 ![]() 溶液
溶液 ![]() 、
、![]() CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑ ![]()
![]() 89.28%
89.28%
【解析】
(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是加快物质溶解,
因此,本题正确答案是:加快物质溶解;
(2) 向粗盐水中加入过量BaCl2溶液,硫酸根离子与氯化钡溶液反应生成硫酸钡沉淀,通过过滤除去硫酸钡,从而除去杂质SO42-,所以加入的X溶液是BaCl2溶液,
因此,本题正确答案是:BaCl2溶液;
(3) ①过程Ⅲ中,加入过量的碳酸钠溶液,将Ca2+转变为![]() 沉淀,将Fe3+转变为
沉淀,将Fe3+转变为![]() 沉淀,Mg2+转变为
沉淀,Mg2+转变为![]() 沉淀,将过程Ⅱ引入的多余Ba2+转变为
沉淀,将过程Ⅱ引入的多余Ba2+转变为![]() 沉淀,
沉淀,
因此,本题正确答案是:![]() 、
、![]() ;
;
②过程Ⅳ中调节pH时,溶液中含有CO32-,所以发生的主要反应的离子方程式为CO32-+2H+=H2O+CO2↑,
因此,本题正确答案是:CO32-+2H+=H2O+CO2↑;
(4) ①过程Ⅴ加入次氯酸钠,次氯酸根离子能够氧化NH4+生成N2,本身被还原为Cl-,根据电荷守恒和电子守恒,配平离子方程式:![]()
因此,本题正确答案是:![]() ;
;
②盐水b中含有SO42-,Na2S2O3将![]() 还原为
还原为![]() ,Na2S2O3被氧化成硫酸根离子,反应的离子方程式为:5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O,IO3-为氧化剂,S2O32-为还原剂,则氧化剂和还原剂的物质的量之比为8:5,
,Na2S2O3被氧化成硫酸根离子,反应的离子方程式为:5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O,IO3-为氧化剂,S2O32-为还原剂,则氧化剂和还原剂的物质的量之比为8:5,
因此,本题正确答案是:8:5;
③从三次滴定数据可知,第二次结果偏差较大,舍去不用,取第一次和第三次的平均值,消耗碘水的体积V=![]() =28.80mL;
=28.80mL;
根据![]() ,知消耗的Na2S2O3的物质的量n(S2O32-)=2n(I2)=2×0.0500mol/L×28.80×10-3L=2.88×10-3mol,
,知消耗的Na2S2O3的物质的量n(S2O32-)=2n(I2)=2×0.0500mol/L×28.80×10-3L=2.88×10-3mol,
根据现称取8.00g硫代硫酸钠固体样品配成250mL的溶液,取25.00mL置于锥形瓶中,则被滴定的Na2S2O3![]() 5H2O质量为0.80g,
5H2O质量为0.80g,
故样品中硫代硫酸钠纯度为![]() ×100%=89.28%;
×100%=89.28%;
因此,本题正确答案是:89.28%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是( )
A. 容器①、②中反应的平衡常数相等
B. 平衡时,两个容器中NH3的体积分数均为1/7
C. 容器②中达平衡时放出的热量Q=23.15kJ
D. 若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
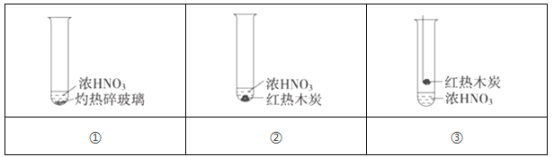
A. 由①中的红棕色气体,推断浓硝酸受热易分解,应保存在低温阴暗处
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:______________________。
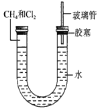
(2)若题目中甲烷与氯气的体积比为1:1,则得到的产物为________。
A.CH3Cl、HCl B.CCl4、HCl C.CH3Cl、CH2Cl2 D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
(3)经过几个小时的反应后,U形管右端的水柱变化是___________。
A.升高 B.降低 C.不变 D.无法确定
(4)若水中含有Na2SiO3,则在U形管左端会观察到_________________________。
(5)右端玻璃管的作用是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采取CO(g)和![]() (g)合成
(g)合成![]() (g)
(g)
(1)已知某温度和压强下
①![]()
![]()
②![]()
![]()
③![]()
![]()
则在相同温度和压强下,CO(g)与![]() (g)合成
(g)合成![]() (g)的热化学方程式__________。
(g)的热化学方程式__________。
若反应生成6.4g甲醇,则转移电子的物质的量为__________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如图,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
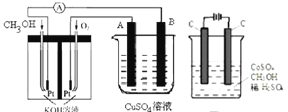
①写出燃料电池负极的电极反应式__________。
②若利用该燃料电池提供电源,与图右边烧杯相连,在铁件表面镀铜,则铁件应是__________极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为__________L。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将![]() 氧化成
氧化成![]() ,然后将甲醇氧化成CO和
,然后将甲醇氧化成CO和![]() (用石墨烯除去
(用石墨烯除去![]() )现用如图所示装置模拟上述过程,则
)现用如图所示装置模拟上述过程,则![]() 在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1 的较浓氨水沿玻璃棒加人到u mL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀氨水。若c1 =2c2,则:
A. w1>2w2,u>50 B. w1<2w2,u<50 C. w1=2w2,u<50 D. w1<2w2,u>50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca、Sr、Ba是第IIA族相邻的三种元素,下列关于Sr的推测正确的是
A.Sr是一种金属元素B.Sr是一种良好的半导体材料
C.Sr的硫酸盐易溶于水D.Sr的最高价氧化物对应水化物是一种强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯代烃中不能由烯烃与氯化氢加成直接得到的有( )
A. 2一乙基—4—氯—1—丁烯 B. 氯代环己烷
C. 2,2,3,3—四甲基—1—氯丁烷 D. 3一甲基—3—氯戊烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com