
【题目】下列离子中,电子数大于质子数,且质子数大于中子数的是:
A. OH- B. Mg2+ C. OD- D. D3O+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为____________。
(2)写出实验②发生反应的离子方程式: 。
(3)C常用作净水剂,用离子方程式表示其净水原理: 。
Ⅱ.某强酸性溶液X可能含有A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-中的若干种,取该溶液进行连续实验,实验过程及产物如下:
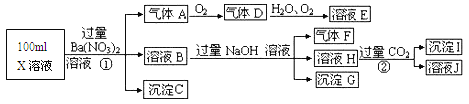
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子有_____________肯定不存在的离子是_________________
(2)请设计简单的实验检验不能确定是否含有的离子(若不止一种,可任选一种)的存在:____________________。
(3)写出反应①的离子方程式:________________。
(4)假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,当沉淀C的物质的量大于0.7mol时,溶液X中还一定含有____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中进行如下反应:2SO2(g)+O2(g)![]() 2SO3(g)。当SO2、O2、SO3的浓度不再改变时,下列说法正确的是
2SO3(g)。当SO2、O2、SO3的浓度不再改变时,下列说法正确的是
A.SO2、O2完全转化为SO3
B.正、逆反应速率相等且等于零
C.反应已达到化学平衡状态
D.SO2、O2、SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类或归类正确的是:①铝热剂、纯净矿泉水、冰水混合物均为混合物 ②NaOH、HD、H2O均为化合物③明矾、烧碱、硫酸均为强电解质④C60、金刚石、石墨均为碳的同素异形体⑤碘酒、淀粉溶液、水雾、纳米材料均为胶体
A.①③③⑤ B.③④⑤ C.②④⑤ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:

(1)降低温度,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是____ _____。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)Y在周期表中的位置是 。
(4)比较W、X、Y、Z四种元素简单离子的半径大小(用化学式表示,下同): > > > ;比较Y、Z的气态氢化物稳定性强弱: > 。
(5)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为: 。
(6)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量,写出该反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国气象局的数据显示,2013年全国平均雾霾天数为52年来之最。形成雾霾的主要成份为:生产生活中排放的废气、汽车尾气及扬尘等。
(1)己知:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-4lkJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0mol H2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为_________,由此可知在该温度下反应CO(g)+H2O(g)
CO2(g)+H2(g)△H=-4lkJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0mol H2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为_________,由此可知在该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的化学平衡常数为_________(保留小数点后一位)。
CO2(g)+H2(g)的化学平衡常数为_________(保留小数点后一位)。
(2)碱式硫酸铝法烟气脱硫工艺主要有以下三步
①向Al2(SO4)3溶液中投入粉末状石灰石,生成碱式硫酸铝[Al2(SO4)3Al2O3]溶液.
②碱式硫酸铝吸收SO2,Al2(SO4)3Al2O3+3SO2=Al2(SO4)3Al2(SO3)3,请写出Al2(SO4)3Al2O3与过量烧碱溶液反应的化学方程式:_________;
③将Al2(SO4)3Al2 (SO3)3氧化成Al2(SO4)3,可选用氧化剂为_________(填代号).
a.浓硫酸 b.KMnO4溶液 C.5%的H2O2溶液 d.空气
该步反应的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H1N1病毒是一种没有超常抵抗力的病毒.研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将H1N1病毒杀灭.
(1)工业上制取漂白粉的反应方程式为 。
(2)将漂白粉溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液出现白色沉淀,写出其中一个化学方程式 。另取少许上层清液,滴加适量的 (填化学式)即可检验Cl﹣的存在,发生反应的化学方程式为 。
(3)漂白粉在空气中长期放置,会失效,用化学方程式解释其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com