
【题目】

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
【答案】(1)增大青蒿素与乙醚的接触面积,提高浸取率
(2)漏斗和玻璃棒;蒸馏
(3)B
(4)①氯化钙或五氧化二磷;碱石灰;②在F后连接一个装有碱石灰的干燥管或U形管;③C15H22O5
(5)C
(6)B
【解析】试题分析:根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品,
(1)根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,故答案为:增大青蒿与乙醚的接触面积,提高青蒿素的浸取率;
(2)根据上面的分析,操作I为过滤,需要的玻璃仪器主要有:烧杯、漏斗、玻璃棒,操作Ⅱ的名称是蒸馏,故答案为:漏斗、玻璃棒;蒸馏;
(3)根据上面的分析可知,粗品中加95%的乙醇,浓缩、结晶、过滤可得精品,故选B;
(4)为了能准确测量青蒿素燃烧生成的CO2和H2O,实验前应通入除去CO2和H2O的空气,排除装置内的空气,防止干扰实验.E和F一个吸收生成的H2O,一个吸收生成的CO2,应先吸水后再吸收CO2,所以E内装的CaCl2或P2O5,而F中为碱石灰,而在F后应再加入一个装置防止外界空气中CO2,和H2O进入的装置。
①根据上面的分析可知,装置E中盛放的物质是 CaCl2或P2O5,装置F中盛放的物质是 碱石灰,故答案为:CaCl2或P2O5;碱石灰;
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是 在装置F后连接一个防止空气中的CO和水蒸气进入F的装置,故答案为:在装置F后连接一个防止空气中的CO和水蒸气进入F的装置;
③由数据可知 m(H2o)=42.4-22.6=19.8g,所以n(H2o)=1.1mol,m(co2)=146.2-80.2=66g,所以 n(co2)=1.5mol,所以青蒿素中氧原子的质量为m(o)=28.2-(2.2×1)-(1.5×12)=6g,所以n(o)=0.5mol,N(C):N(H):N(o)=1.5:2.2:0.5=15:22:5,所以C15H22O5,故答案为:C15H22O5;
(5)由于酯能溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠结合题意可知,青蒿素中含有酯基,故选C;
(6)根据原料的粒度对青蒿素提取速率的影响可知,应为60目,根据提取时间对青蒿素提取速率的影响可知,时间应为120分钟,根据提取温度对青蒿素提取速率的影响可知,温度应为50℃,故选B。


科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1mol,完全燃烧得0.15mol CO2和3.6g H2O,下列关于该混合气体的说法正确的是( )
A.一定有乙烯 B.一定没有乙烯 C.一定有甲烷 D.可能有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)冶炼金属的三种常用方法是:A.热分解法 B.热还原剂法 C.电解法。人类用量处在前三位的金属是铁、铝、铜。(填编号)(化学方程式书写每空2分,其余每空1分)
① 冶炼铝用到的方法是 ;
② 冶炼铁和铜的常用方法是 。
③ 写出电解熔融氯化镁制取金属镁的化学反应方程式: 。
(2)保护环境、保护地球已成为人类共同的呼声。(化学方程式书写每空2分,其余每空1分)
① 引起温室效应的主要物质是 ;
②以煤炭为主的能源结构易导致酸雨的形成,形成这类酸雨的气体是 ,形成过程发生的化学反应有: 、 (写出两个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)写出R的原子结构示意图:________________
(2)五种元素原子半径由大到小的顺序是(写元素符号) .
(3)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,X和Z组成的化合物的化学式为___________________
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
①如果A、B均由三种元素组成,B为两性不溶物,则A![]() B离子反应方程式为_________
B离子反应方程式为_________
②A、B均为盐溶液,如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)A在周期表中的位置是 。AFD的电子式为 。
(2)BD2的结构式为 ; BD2形成晶体的类型为 。
(3)元素D、E 、F形成的简单离子的半径由大到小为 (用离子符号表示)。
(4)写出实验室制备单质F的离子方程式 。
(5)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在元素周期表中的相对位置如下图所示。下列说法一定正确的是
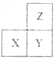
A. 若X为非金属元素,则离子半径:Xn->Ym->Zm-
B. X、Y、Z的单质中,Z单质的熔点最高
C. 最高正化合价:Z>X
D. X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用。
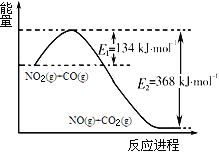
(1)右图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() 其化学平衡常数K与温度t的关系如下表:
其化学平衡常数K与温度t的关系如下表:

完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.![]()
B.![]()
C.容器内压强保持不变
D.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com