
����Ŀ�����ǵ����Ϻ����Ϸḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ�������ճ�������������Ҫ���á�
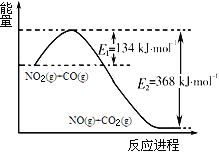
��1����ͼ��1mol NO2(g)��1mol CO(g)��Ӧ����CO2(g)��NO(g)�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
��2����һ��������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() �仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���

����������⣺
�ٱȽ�K1��K2�Ĵ�С��K1 K2���>������=����<������
���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� ������ţ���
A��![]()
B��![]()
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
���𰸡���1��2NO2��g��+4CO��g��=N2��g��+4CO2��g����H=-234KJ/mol��2����>��AC
��������
�����������1������ͼʾ��298k������1mol NO2��1mol CO��Ӧ����1mol CO2��1mol NO���Ȼ�ѧ����ʽΪ2NO2��g��+4CO��g��=N2��g��+4CO2��g����H=-��368-134��KJ/mol=-234KJ/mol��
��2��������Ӧ���ȣ������¶�ƽ�������ƶ���ƽ�ⳣ����С��K1>K2����A�����淴Ӧ���ʵ���ϵ���ȣ�![]() һ��ƽ�⣻ B�����淴Ӧ���ʵ���ϵ���ȣ�����
һ��ƽ�⣻ B�����淴Ӧ���ʵ���ϵ���ȣ�����![]() ����ƽ�⣻C����Ӧ���������ʵ����ı䣬����ѹǿΪ������������ѹǿ���ֲ���һ��ƽ�⣻ D������
����ƽ�⣻C����Ӧ���������ʵ����ı䣬����ѹǿΪ������������ѹǿ���ֲ���һ��ƽ�⣻ D������![]() ���ܶ��Ǻ��������������ܶȱ��ֲ��䲻һ��ƽ����
���ܶ��Ǻ��������������ܶȱ��ֲ��䲻һ��ƽ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��

��ش��������⣺
��1����������и��������Ŀ����_____________��
��2������I��Ҫ�IJ���������Ҫ�У��ձ���_________����������������_______________��
��3������������Ҫ���̿�����_____________(����ĸ)��
A����ˮ�ܽ⣬����Ũ������ȴ�ᾧ
B����95�����Ҵ���Ũ�����ᾧ������
C���������ѽ�����ȡ��Һ
��4��������ʵ��װ�òⶨ�����ط���ʽ�ķ������£���28��2g��������Ʒ����Ӳ�ʲ�����C�У�����ͨ����������Ӻ��ٳ��ȼ�գ���ȷ�ⶨװ��E��Fʵ��ǰ��������������������ݼ��㡣

��װ��E��ʢ�ŵ�������______________��װ��F��ʢ�ŵ�������________________��
����ʵ��װ�ÿ��ܻ��������ɲⶨ������ƫ�ͣ��Ľ�������_______________��
���ú����Ľ����װ�ý������飬�Ƶã�

���������ص����ʽ��__________________��
��5��ijѧ���������ص����ʽ���̽�����������ؼ��뺬��NaOH����̪��ˮ��Һ�У������ص��ܽ�����С�����Ȳ����裬�����ص��ܽ�����������Һ��ɫ��dz��˵����������____________(����ĸ)������ͬ�����ʡ�
A���Ҵ� B������ C���������� D��������
��6��ij����С�龭�����ȡ������ʵ����Ϊ��ʯ�������ܼ���Ϊ���ˣ�ʵ����ͨ����������ʵ���������䣬���о�ԭ�ϵ����ȡ���ȡʱ�����ȡ�¶ȶ���������ȡ���ʵ�Ӱ�죬��������ͼ��ʾ��

����ͼ��֪��������ʵ���������䣬���õ�������ȡ�ʱ����¶�Ϊ_______________��
A��80Ŀ��100���ӡ�50�� B��60Ŀ��120���ӡ�50�� C��60Ŀ��120���ӡ�55��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ��ʾ��ͼ����ͼ��ʾ������˵���У���ȷ���ǣ� ��

A. ȼ�ϵ�ع���ʱ��������ӦΪ��O2 + 2H2O + 4e���� 4OH��
B. a��������b����ͭʱ��b�����ܽ⣬a������ͭ����
C. a���Ǵ�ͭ��b���Ǵ�ͭʱ��a�����ܽ⣬b������ͭ����
D. a��b��������ʯīʱ������ͬ������a���������������������ĵ�H2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��ѧ���̵Ļ�ѧʽ��д��ȷ���ǣ�
A������������Һ�Լ��ԣ�SO32��+2 H2O![]() H2SO3 +2 OH��
H2SO3 +2 OH��
B���Ȼ���Ͷ��ˮ�к���ƽ�⣺AgCl (s)![]() Ag+ (aq) + Cl��(aq)
Ag+ (aq) + Cl��(aq)
C�������ȼ����Ϊ890.3kJ��mol-1����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ��
CH4(g)+2O2(g)��CO2(g)+2H2O(g) ��H=��890.3kJ��mol-1
D��500����30MPa������0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H=��38.6 kJ��mol-1
2NH3(g) ��H=��38.6 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ԭ����������Ӧ������Ԫ�أ����γ�AB2�����ӻ��������
A. 6��8 B. 11��13 C. 11��16 D. 12��17
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ���ҡ�ЧӦ������CO2����ȼ�ϼ״���
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1
CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1
��1������ͬ�¶Ⱥ��ݻ�����ʱ����˵���÷�Ӧ�Ѵ�ƽ��״̬���� ��
A��n(CO2)��n(H2)��n(CH3OH)��n(H2O)��1��3��1��1
B��������ѹǿ���ֲ���
C��H2������������CH3OH����������֮��Ϊ3��1
D�������ڵ��ܶȱ��ֲ���
��2��һ���¶��£���6 mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ��ʾ(ʵ��)��ͼ������a(1,6)��������˼�ǣ���1 minʱH2�����ʵ�����6 mol��
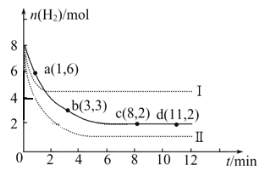
��a������Ӧ���� �淴Ӧ����(����ڡ��������ڡ���С�ڡ�)����1��3min�ڵ�ƽ����Ӧ����v��H2��= ��
�ڽ��ı�ijһʵ������ʱ�����H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� ������II��Ӧ��ʵ�������ı��� ��
��3���״�����������ȼ�ϵ�أ����������ҺΪ���ԣ������ĵ缫��ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij��Һ���������ӵļ��������ж���ȷ����
A������BaCl2��Һ�����ɰ�ɫ��������ϡ�����������ʧ����ԭ��Һ��һ������SO42-
B������NaOH��Һ�����ɵİ�ɫ�����ڿ�����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ����ԭ��Һ��һ������Fe2+��
C���ýྻ�IJ�˿պȡ��Һ�ڻ��������գ�������ɫ�Ļ��棬��ԭ��Һ��һ��������K+
D�������ᣬ���ɵ�������ʹ����ʯ��ˮ����ǣ���ԭ��Һ��һ������CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��������Σ������������ε��ǣ� ��
A��NaCl B��CuSO4 C��Na2SO4 D��KNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ˮ�Ǿ����Դ���⣬��ҵ�ϴӺ�ˮ����ȡʳ�κ���Ĺ������£�
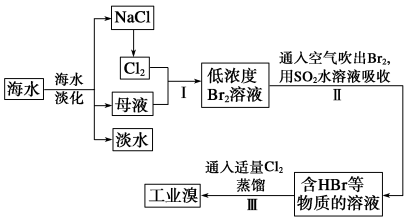
������������Ӧ�����ӷ���ʽΪ�� �������̼������Һ����������еĶ�������ˮ��Һ��������������Ļ��ϼ۷ֱ�Ϊ��5�ͣ�1�ۣ��Ҳ���������ϡ���������������д����������²������з�����Ӧ�����ӷ���ʽ�� ��
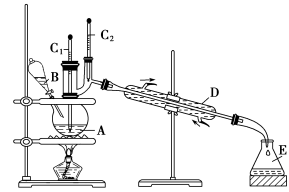
��2���屽��һ�ֻ���ԭ�ϣ���������ͱ���Ӧ�ϳɡ�ʵ���Һϳ��屽��װ��ʾ��ͼ���£�
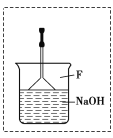
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
�ϱ�Ϊ��������屽��������� ���ش��������⣺
��A�м���30.0mL��ˮ����������м����B��С�ļ���8.0mLҺ̬�塣
��A�еμ�Һ�壬��Ӧһ��ʱ���ȼ�ƾ��Ƽ�������
�� A���ݻ����ʺϵ���________(����)��
a��25mL b��50mL c��100mL d��250mL
�� �ռ��屽ʱ��Ӧ����_______(����C1������C2��)����ʾ���¶ȣ����¶�ӦΪ__________��
�� �ڷ�Ӧ��ʼ���ռ��屽֮ǰ��Ӧ�Ƚ�Fװ��������Dװ�ú������������ճнӵ�������������________________(�ѧ����)��
�� ij��ѧС���������ʵ�鷽����֤�������巢������ȡ����Ӧ�����Ǽӳɷ�Ӧ��
��һ����ȡ������Ӧ��Fװ���е���Һ���Թ��У�
�ڶ����������м��������ϡ���
�������������μ���������������Һ��
�����dz��ɫ����������֤�������巢������ȡ����Ӧ����ʵ�鷽��________(����������������������)�������ǣ� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com