
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究。已知A是强酸,B是块状固体。打开分液漏斗的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
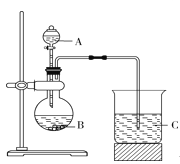
(1)甲同学设计实验的理论依据是_________________。
(2)写出选用的物质:A____________,B____________,C________(填化学式)。
(3)烧杯中反应的离子方程式为______________________。
(4)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,该装置中应盛放________(填试剂名称)溶液,目的是_____________________。
Ⅱ.丙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
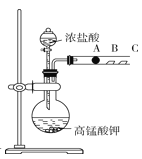
(5)A处的实验现象为_________;写出B处反应的离子方程式:____________;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是_________。
(6)丙同学利用此实验证明卤素单质氧化性Cl2>Br2>I2,你认为此实验_____(填“合理”或“不合理”),理由是_______。
【答案】(1) 强酸制弱酸 (2)HNO3 CaCO3Na2SiO3
(3)CO2 + SiO32―+ H2O = H2SiO3↓+ CO32―或2CO2 + SiO32―+ 2H2O = H2SiO3↓+ 2HCO3―
(4) 碳酸氢钠吸收挥发出来的硝酸,避免干扰
(5) 棉花由白色变为橙黄色 2I-+Cl2=2Cl-+I2 NaCl和KCl (6)不合理 不能验证Br2和I2的氧化性强弱
【解析】
试题(1)根据元素非金属性与对应最高价含氧酸之间的关系,比较最高价含氧酸的酸性强弱,根据甲设计的实验装置图可知,其实验的原理是利用较强酸制较弱酸。
(2)氮、碳、硅对应的酸是硝酸、碳酸及硅酸,利用强酸与弱酸盐反应制弱酸,故实验A、B、C中的试剂分别是稀硝酸、碳酸钙、硅酸钠溶液。
(3)有关反应的离子方程式分别是CaCO3+2H+===Ca2++2CO2↑+H2O、![]() ,故烧杯中发生第二步反应。
,故烧杯中发生第二步反应。
(4)挥发出来的硝酸,会干扰实验,故应加一个饱和碳酸氢钠除杂质。
(5)高锰酸钾与盐酸制备了氯气,被棉花吸收,变成橙黄色;B处反应的离子方程式是2I-+Cl2=2Cl-+I2,向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,溴化钠变成溴,加热挥发了,碘化钾变成碘,升华了,最后得到的物质是NaCl和KCl。
(6)有氯气存在,不能验证Br2和I2的氧化性强弱。


科目:高中化学 来源: 题型:
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的溶度恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量的比为( )
A.2:1B.2:3C.3:2D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
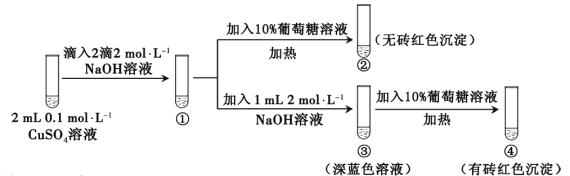
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示进行电化学实验,电极材料为铜和另一电极X,则以下说法中错误的是( )

A. 铜电极上既可能发生反应:Cu-2e- =Cu2+,又可能发生 Cu2++2e- =Cu
B. 该装置既可实现化学能转化成电能,又能实现电能转化成化学能
C. X电极上既可能产生H2,又可能产生O2
D. 该装置既可做电镀铜的实验,又可以研究精炼铜的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下图所示:
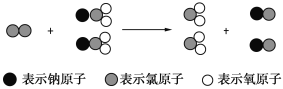
下列有关该反应的叙述中正确的是 ( )
A. 该反应是置换反应
B. 该反应的化学方程式为Cl2+NaClO2===ClO2+NaCl
C. 反应中Cl2既是氧化剂,又是还原剂
D. 氧化性: Cl2 > ClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.欲配制0.18 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________g无水醋酸钠,溶于适量水中,配成500 mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将___________(填“偏大”“偏小”或“无影响”)。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
Ⅱ.某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)写出上述反应的化学方程式______________________________
(2) NaH2PO2 为__________ (填“正盐”或“酸式盐”),
(3)已知NaH2PO2水溶液pH>7,次磷酸的电离方程式为______________________;
NaH2PO2水溶液pH>7的原因:________________________________________。
(4)H3PO2 及 NaH2PO2均可将溶液中的 Ag+ 还原为银,从而可用于化学镀银。
利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属元素特征的叙述,正确的是
A. 金属元素的原子只有还原性,离子只有氧化性
B. 金属元素在化合物中一定显正价
C. 金属单质都可以和酸反应置换出氢气
D. 金属元素的单质在常温下均为固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于( )
A.发现了元素周期律B.提出了原子分子学说
C.揭示了燃烧的本质D.提取了治疟药物青蒿素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com