
【题目】下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)>c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-)=2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
【答案】AC
【解析】
选项A:PH=2的HA溶液与PH=12的MOH溶液任意比混合,酸和碱发生反应后的溶液中存在的离子有:H+、M+、OH-、A-,无论酸碱的相对多少如何,溶液总是呈电中性的,根据电荷守恒有:c(H+)+c(M+)=c(OH-)+c(A-) ,即该选项正确;
选项B:PH相等的CH3COONa, NaOH, Na2CO3三种溶液中,NaOH的浓度最小,因为它是强碱,Na2CO3的浓度小于CH3COONa的浓度,因为醋酸比碳酸强,所以Na2CO3的水解程度大于CH3COONa。即该选项错误。
选项C:物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,即混合溶液中CH3COOH和CH3COONa物质的量相等,为了分析的方便,不妨假设它们的物质的量均为1mol,溶液中存在以下三个平衡:
CH3COOH![]() CH3COO- + H+ CH3COO- + H2O
CH3COO- + H+ CH3COO- + H2O![]() CH3COOH+OH-
CH3COOH+OH-
H2O![]() H++OH-
H++OH-
根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ①
根据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+) ②
将①代入②消去2c(Na+)即得:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+) ,所以该选项正确;
选项D: 0.1moL/L的NaHA溶液中存在三个平衡;
H2O![]() H++OH- HA-+H2O
H++OH- HA-+H2O![]() H2A + OH- HA-
H2A + OH- HA-![]() H++A2-
H++A2-
已知其PH=4,说明电离强于水解,即c(A2-)>c(H2A),所以该项错误


科目:高中化学 来源: 题型:
【题目】【化学-有机化学基础】利用从冬青中提取的有机物A合成结肠炎药物及其它化学品,合成路线如下:
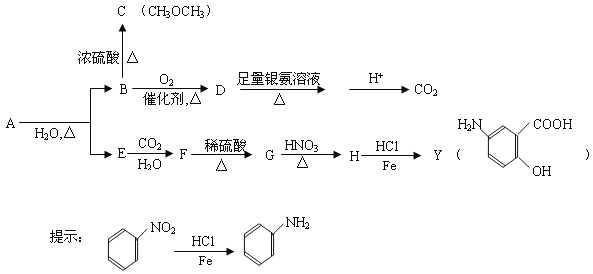
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是__________。B→C的反应类型是______。
(2)写出A生成B和E的化学反应方程式__________________。
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成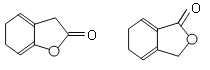 ,鉴别I和J的试剂为______________________。
,鉴别I和J的试剂为______________________。
(4)A的另一种同分异构体K用于合成高分子材料K可由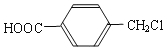 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:__________________。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验中预计需要使用480 mLamol/L的纯碱溶液,下面是某同学在实验室配制该溶液的流程图,回答下列问题:


(1)流程图中的配制过程少了一步,请指出缺少的步骤是_____________。
(2)最合适的V值为________,由此值求出的a=________,使用容量瓶前对容量瓶必须进行的一项操作是______________________。
(3)所给出的流程图中体现出的操作内容有三个错误,请写出:_____________、___________、____________________。
(4)指出下列实验操作对结果以及对所配制溶液浓度的影响,填写“偏大”“偏小”或者“无影响”。
①转移溶液时容量瓶中有少量的蒸馏水:________;
②定容时俯视刻度线:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)主要用作氯化剂或氯磺化剂,也用于制造医药品、染料、表面活性剂等,熔、沸点分别为-54.1℃和69.2℃。

(1)SO2Cl2中S的化合价为______,SO2Cl2在潮湿空气中发生剧烈反应,散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为____________________。
(2)拟用干燥的SO2和Cl2通入如图装置(省略夹持装置)制取磺酰氯。
①仪器A的名称为___________,通水方向为___________(填 “a→b”或“b→a”),装置B的作用是___________。
②反应装置中的活性炭的作用可能为:______________。
③若SO2和Cl2未经干燥,就通入装置中,也散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为_________。
④滴定法测定磺酰氯的纯度:取1.800g产品,加入到100mL0.5000mol·L1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl溶液滴定至终点,重复实验三次取平均值,消耗10.00mL。 达到滴定终点的现象为___________,产品的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F是一种常见的α-氨基酸,可通过下列路线人工合成:

回答下列问题:
(1)化合物E中的官能团名称是______________,烃A的结构简式是________________。
(2)由化合物D生成E、醇C生成D的反应类型分别是__________、_______________。
(3)化合物F的系统命名为____________,F相互形成的环状二肽的结构简式为__________。
(4)化合物C可在灼热Cu催化下与O2发生反应,得到一种具有刺激性气味的液体,写出相关的化学方程式_______________________________________。
(5)化合物E与足量NaOH醇溶液加热反应,反应方程式为_______。
(6)烃A可与苯酚在酸性条件下产生苯酚对位取代衍生物G(C8H10O),其满足如下条件 的G的同分异构体有_______种。
①遇FeCl3溶液不显紫色;② 苯环上有两个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3-CH=CH-COOH。现有①氯化氢;②溴水;③纯碱溶液;④丁醇;⑤酸性高锰酸钾溶液。试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是
A.②④⑤B.①③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A. 原子半径:Na>Mg>O
B. 13C和14C属于同位素
C. 0族元素是同周期中非金属性最强的元素
D. N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解絮凝净水可用如图装置模拟探究,下列叙述正确的是

A. 电子从X极经电解液流入Y极
B. 铝电极表面的反应有:Al -3e-=Al3+,4OH--4e-=O2↑+2H2O
C. Y的电极反应:Pb-2e-+SO42- = PbSO4
D. 电路每通过2mol电子,理论上电解池阴极上有22.4 L H2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com