
��16�֣����ȫ�����س���������������������Ҫ��Ⱦ���ǿ����������PM2.5�͵������������(PM2.5ֱ���ӽ�2.5��10-6m��1����=10-9m)����Ҫ��ԴΪ��ҵ������������β���ȡ���˶�PM2.5��SO2��NOx�����о������������ش�
(1) ���й���PM2.5˵����ȷ����
a.PM2.5�ڿ������γ��˽��壻
b.PM2.5������������������ж����к����ʣ�
c.�ٿ�˽�ҳ�������ѡ�����������У�ij�̶ֳȿ��Լ���PM2.5��Ⱦ
(2) ȡPM2.5����������ˮ�����Ƶ�����������ø���������ˮ���������Ӽ���ƽ��
Ũ�����±�
| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ��/ mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
 2NO(g) ��H=+180.5kJ��mol-1
2NO(g) ��H=+180.5kJ��mol-1  2CO(g) ��H ="-" 221.0 kJ��mol-1
2CO(g) ��H ="-" 221.0 kJ��mol-1 CO2( g) ��H ="-" 393.5 kJ��mol-1
CO2( g) ��H ="-" 393.5 kJ��mol-1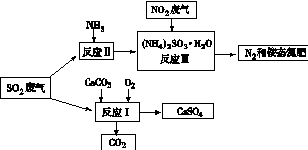
��16�֣�
��1��b��c ��2�֣�
(2)���� 4 ����1�֣���2�֣�
��3�� �� 3NO2 + H2O = 2HNO3 + NO ��2�֣�
�ڼ�С ��2�֣�
2NO (g)+2 CO (g) =N2(g)+2CO2(g) ��H ="-" 746.5kJ/mol ��2�֣�
��4���� 2CaCO3 +O2 +2SO2�� 2CaSO4 + 2CO2 ��2�֣�
�ڷ�ֹ�������(NH4) 2 SO3������ ��2�֣�
��������Ȼ�����HCl �� BaCl2) ��2�֣�
���������������1��a��PM2.5��ָ��ֱ����2.5��10-6������������ֱ��Ϊ1��100nm������10-9��10-7��֮�䣬���ڿ����в�ֻ�γ��˽��壬������Һ����a����b��PM2.5ֱ��С��������������������ж����к����ʣ���b��ȷ��c���ٿ�˽�ҳ�������ѡ�����������У�ij�̶ֳȿ��Լ���PM2.5��Ⱦ����c��ȷ����ѡbc��
��2���۲�����з���NH4+ˮ�������ԣ�PM2.5�������Ϊ���ԣ�������pHֵ������Һ�е���غ��c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)����c(H+)= 10-4mol/L��pHֵΪ4��
��3����NO2ת��ΪHNO3�Ļ�ѧ����ʽΪ��3NO2+H2O=2HNO3+NO��
�ڢ�N2��g��+O2��g���T2NO��g����H=+180.5kJ?mol-1 ��
��2C��s��+O2��g���T2CO��g����H=-221.0kJ?mol-1 ��
��C��s��+O2��g���TCO2�� g����H=-393.5kJ?mol-1 ��
��Ӧ������Ӧ���ȣ��¶�����ƽ�������ƶ�����Ӧ��Ũ������������Ũ�ȼ�С����ѧƽ�ⳣ����С��
�ɸ�˹���ɣ�NO��g����CO��g����Ӧ����N2��g����CO2��g�����Ȼ�ѧ����ʽ���ɢۡ�2-��-�ڵõ�����2NO��g��+2CO��g��=N2��g��+2CO2��g����H=-746.5kJ/mol��
��4���ٸ��ݷ�Ӧ��������д����Ӧ��Ļ�ѧ����ʽΪ��2CaCO3+O2+2SO2=2CaSO4+2CO2��
��������������ױ������е�����������������Ӧ�����Һ�м���ǿ��ԭ�ԵĶԱ����ӵ����ʣ�Ŀ���Ƿ�ֹ������泥�NH4��2SO3��������
�ۼ���SO42-�����Լ���������Ȼ�����HCl��BaCl2����
���㣺���鳣�������������Ⱦ����������Ӧ�Ⱥ��ʱ䣻�Ȼ�ѧ����ʽ����ѧƽ�ⳣ���ĺ��壻��������Ļ�ѧ���ʣ���������ӵļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�����������ѵķ����ܶࡣ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ������Ĺ�������ͼ���£�������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��
FeTiO3��2H2SO4��TiOSO4��FeSO4��2H2O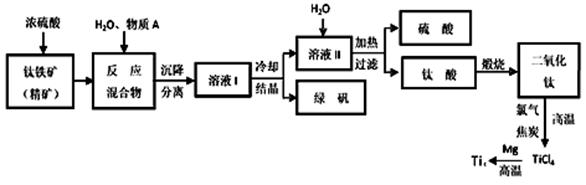
�ش��������⣺
��1���������Ũ���ᷴӦ����______________________ ��ѡ�������ԭ��Ӧ����������ԭ��Ӧ������
��2���������������м�������A��Ŀ���Ƿ�ֹFe2��������������A��________�������Ʊ�TiO2�Ĺ����У����õ��ĸ�����Ϳɻ������õ����ʷֱ���__________��___________��
��3����ӦTiCl4��2Mg��2MgCl2��Ti��Ar�����н��е�������_______________��
��4���ɶ���������ȡ���Ȼ������漰�ķ�Ӧ�У�
TiO2 (s)+ 2Cl2 (g) +2C(s) ��TiCl4(g) + 2CO(g) ��H1 = ��72 kJ?mol-1
TiO2(s) + 2Cl2 (g) ��TiCl4(g) + O2 (g) ��H2 =+38.8kJ?mol��1
C(s)��CO2(g)��2CO(g)? ��H3 =+282.8kJ?mol��1
�ٷ�ӦC(s)��CO2(g)��2CO(g)�ڸ������ܹ��Է����е�ԭ����______________________��
�ڷ�ӦC(s)��O2(g)��CO2 (g)�Ħ�H��_______________��
��5���о����֣�������ʯī������������������������CaF2-CaO������ʣ�������ͼ��ʾװ�û�ý����ƣ����Ը�Ϊ��ԭ������ԭ���������Ʊ������ѡ���д��������������Ӧ�ĵ缫��Ӧʽ��________________________________��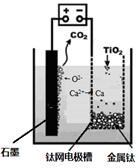
�����Ʊ�������ǰ��CaO���������䣬��ԭ���ǣ����ϻ�ѧ������ͣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������Ҫ�ɷ�ΪFeS2���ǹ�ҵ��ȡ�������Ҫԭ�ϣ���ȼ�ղ���ΪSO2��Fe2O3��
��1����֪1g FeS2��ȫȼ�շų�7.1kJ���������ʾFeS2��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ��
______________________________________________________________��
��2����0.050molSO2(g)��0.030molO2(g)�����ݻ�Ϊ1L���ܱ������У���Ӧ��2SO2(g)��O2(g)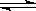 2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��
2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��
��3�����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е��� ��������ĸ��
| A����ƽ�������г���Ar | B����ƽ�������г���O2 |
| C���ı䷴Ӧ�Ĵ��� | D�����ͷ�Ӧ���¶� |
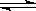 2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��
2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣�A��B��C��D��E��F����ѧ��ѧ�г��������ֶ�����Ԫ�أ��й�λ�ü���Ϣ���£�A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ����C����һ�㱣����ú���У�F������������Ӧ��ˮ����������ᷴӦ������Ӧ��G�������ճ��������������Ľ������ױ���ʴ������ش��������⣺
��1��AԪ�ص��⻯��ˮ��Һ��ʹ��̪����ԭ���õ��뷽��ʽ����Ϊ ��
��2��ͬ��ͬѹ�£���a L A�⻯��������b L D���⻯������ͨ��ˮ�У���������Һ��pH=7����a b(�>"��<����=��)
��3�������£���ͬŨ��F��G�����ӵ���Һ�еμ�NaOH��Һ��F��G��Ԫ���Ⱥ������F (OH)n��ȫ������pH��4.7��G (OH)n��ȫ������pH��2.8����ksp�ϴ���ǣ� ���ѧʽ��
��4��A��B�����������Ϊ7:16����ԭ�ӷ��ӣ��÷����ͷ��ڿ������仯ѧ���ÿ��������ĺ���У� ��
������ ������ЧӦ �۹⻯ѧ���� �ܳ������ƻ�
��5��A��C��ɵ�һ�����ӻ��������ˮ��Ӧ�������ּ�÷�Ӧ�Ļ�ѧ����ʽ�� ��
��6����֪һ������E��������B2 (g)��ȼ�գ�����ܵIJ��P������ϵ������ͼ��ʾ����д��һ��������EB2(g) ��E��s����Ӧ����EB(g)���Ȼ�ѧ����ʽ ��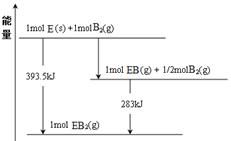

��7������D��G��ɵ�ij�ֻ��������Һ���У�����ͭƬ����Һ��������Ϊ��ɫ�����ݲ���������ķ�Ӧԭ��������Ƶ�ԭ���������ͼ��ʾ���䷴Ӧ��������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��7�֣�(1)���������ھ�������������ˮ������������ҵ�������ΪƯ����
�ٳ������������������ҿ������������е��ʷ�Ӧ���磺
6Ag(s)+O3(g)===3Ag2O(s)����H =" -235.8" kJ/mol;
��֪��2 Ag2O(s)===4Ag(s)+O2(g)����H = +62.2kJ/mol;
��Ӧ 2O3��g��= 3O2��g�� �ġ�H = kJ/mol��
�ڿ�ѧ��P��Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в�
�����������������������ɹ������⣬�����缫��ӦʽΪ �� ��2���û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g) ij�о�С����ij�ܱյ��������(��������������䣬��������������Բ���)�м���NO�������Ļ���̿������(T1��) �����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
��2���û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g) ij�о�С����ij�ܱյ��������(��������������䣬��������������Բ���)�м���NO�������Ļ���̿������(T1��) �����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�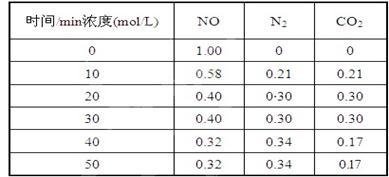
����10 min��20 min��ʱ����ڣ���CO2��ʾ�ķ�Ӧ����Ϊ ��
��д���÷�Ӧ��ƽ�ⳣ���ı���ʽK= ��
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ��״̬���� (�������ĸ)��
| A��������ѹǿ���ֲ��� | B��2v��(NO)=v��(N2) |
| C��������CO2������������� | D�����������ܶȱ��ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣�
��п�̷ϵ���е�̼������̼�ۡ�Fe��Cu��Ag��MnO2������ ��Ϊԭ�ϻ���MnO2�Ĺ����������£�
I. ��̼�������ʺ�ɣ�������ϡHNO3�ܽ�������ʣ����ˣ�������a��
II. ������a�ڿ��������ճ�ȥ̼�ۣ��õ���MnO2��
III.���MnO2�м�������H2O2��Һ��MnO2�ܽ�����Mn2+�����������ɣ�
IV. ��III������Һ��pHԼΪ6���л����μ�0.50 mol?L-1 Na2CO3��Һ�����ˣ�������b������Ҫ�ɷ�ΪMnCO3��
V. ����b��ϴ�ӡ�������գ��Ƶýϴ���MnO2��
��1������Ag������ϡHNO3��Ӧ����NO�Ļ�ѧ����ʽΪ ��
��2����֪II�����չ�����ͬʱ������Ӧ��
MnO2(s) + C(s) ="==" MnO(s) + CO (g) ��H = +24.4kJ ? mol �C1 ��
MnO2(s) + CO(g) ="==" MnO(s) + CO2(g) ��H = -148.1 kJ ? mol �C1 ��
д��MnO2��C��Ӧ����MnO��CO2���Ȼ�ѧ����ʽ�� ��
��3��H2O2�����к��еĻ�ѧ������Ϊ �� ��
��4��III��MnO2�ܽ�����ӷ���ʽΪ ���ܽ�һ������MnO2��H2O2��ʵ��������������ֵ�ߣ��û�ѧ����ʽ����ԭ�� ��
��5��IV�У�����Ϊ����0.50 mol?L-1 Na2CO3��Һ�л����μ�III������Һ��������b�л���н϶�Mn(OH)2������������ԭ�� ��
��6��V��MnCO3�ڿ��������յĻ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�����ߡ�������д���ҹ�������ҵ����ƪ�¡����������Ҫ���ܵ�ȼ�ϣ�ͨ������(N2H4)��Ϊȼ�ϣ�N2O4����������
��1����֪��N2(g) + 2O2(g) =2NO2(g) ��H����67.7 kJ��mol��1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) ��H����534.0 kJ��mol��1
2NO2(g) N2O4(g) ��H����52.7 kJ��mol��1
N2O4(g) ��H����52.7 kJ��mol��1
��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ�� ��
��2����ҵ�Ͽ��ô�������������İ���Ӧ�Ʊ��£��÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��3��һ�������£���2L�ܱ���������ʼͶ��2 mol NH3��4 mol O2������Ӧ��
4NH3(g)+5O2(g�� 4NO(g)+6H2O(g) ��H<0
4NO(g)+6H2O(g) ��H<0
���ƽ��ʱ�������£�
| ƽ��ʱ���ʵ�����mol�� | n(NO) | n(H2O�� |
| �¶�T1 | 1.6 | 2.4 |
| �¶�T2 | 1.2 | 1.8 |
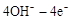 =O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
=O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
���Ŵ�����Ⱦ���������أ������ܼ��š�������ȫ�����������ŷţ��о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1����ͼ����101kPa��298k������1mol NO2��1mol CO��Ӧ����1mol CO2��1mol NO�����������仯ʾ��ͼ��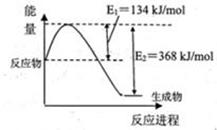
��֪���� N2��g��+O2��g����2NO��g�� ��H=+179.5kJ/mol
�� 2NO��g��+O2��g����2NO2��g�� ��H=-112.3kJ/mol
����298kʱ����Ӧ��2NO(g)��2CO(g) N2(g)��2CO2(g)�ġ�H�� ��
N2(g)��2CO2(g)�ġ�H�� ��
��2����0.20mol NO2��0.10molCO����һ���ݻ��㶨Ϊ1L���ܱ������з�����Ӧ���ڲ�ͬ�����£���Ӧ�����в������ʵ�Ũ�ȱ仯״����ͼ��ʾ��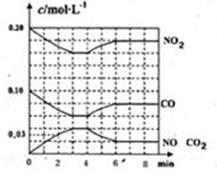
������˵����ȷ���� ��������ţ�
a.�����ڵ�ѹǿ�������仯˵���÷�Ӧ�ﵽƽ��
b.���������м��ٳ���0.20mol NOʱ��ƽ��������Ӧ�����ƶ���Kֵ����
c.�����¶Ⱥ�Kֵ��С��NO2��ת���ʼ�С
d.��������ڳ���He������Ӧ��������С��Ũ���������Է�Ӧ��Ӧ��������
�ڼ������NO��0��2minʱƽ����Ӧ����v(NO)= mol��L-1��min-1��
�۵�4minʱ�ı�ķ�Ӧ����Ϊ ������¡��������¡�����
�ܼ��㷴Ӧ�ڵ�6minʱ��ƽ�ⳣ��K= ���������¶Ȳ��䣬��ʱ���������г���CO��NO��0.060mol��ƽ�⽫ �ƶ��������������������
��3����ѧ��������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϡ��为���ķ�ӦʽΪ ������0.25molSO2�����գ���ͨ�����ӣ�H+������Ĥ��H+�����ʵ���Ϊ ��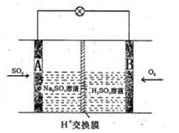
��4��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���KSP=2.8��10-9mol2/L2���ֽ�2��10-4mol/L��Na2CO3��Һ��һ��Ũ�ȵ�CaC12��Һ�����������ɳ���������Ӧ����CaC12��Һ����СŨ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������£������ܱ������н��еĿ��淴ӦA��g����3B��g��
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com