
��7�֣�(1)���������ھ�������������ˮ������������ҵ�������ΪƯ����
�ٳ������������������ҿ������������е��ʷ�Ӧ���磺
6Ag(s)+O3(g)===3Ag2O(s)����H =" -235.8" kJ/mol;
��֪��2 Ag2O(s)===4Ag(s)+O2(g)����H = +62.2kJ/mol;
��Ӧ 2O3��g��= 3O2��g�� �ġ�H = kJ/mol��
�ڿ�ѧ��P��Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в�
�����������������������ɹ������⣬�����缫��ӦʽΪ �� ��2���û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g) ij�о�С����ij�ܱյ��������(��������������䣬��������������Բ���)�м���NO�������Ļ���̿������(T1��) �����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
��2���û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g) ij�о�С����ij�ܱյ��������(��������������䣬��������������Բ���)�м���NO�������Ļ���̿������(T1��) �����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�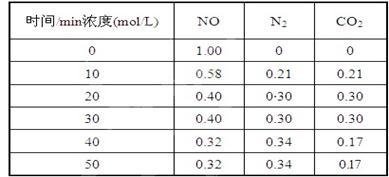
����10 min��20 min��ʱ����ڣ���CO2��ʾ�ķ�Ӧ����Ϊ ��
��д���÷�Ӧ��ƽ�ⳣ���ı���ʽK= ��
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ��״̬���� (�������ĸ)��
| A��������ѹǿ���ֲ��� | B��2v��(NO)=v��(N2) |
| C��������CO2������������� | D�����������ܶȱ��ֲ��� |
��7�֣�����1����-285kJ/mol��
��3O2+6H++6e-=3H2O2��
��2������1����0.009/mol/��L.min��
��0.56��
��C��D
�ܼ�СCO2Ũ��
�� ���䡣
���������������1���٢�6Ag��s��+O3��g���T3Ag2O��s������H=-235.8kJ?mol-1��
��2Ag2O��s���T4Ag��s��+O2��g������H=+62.2kJ?mol-1�����ݸ�˹���ɿ�֪�١�2+
�ڡ�3�ɵõ���2O3��g��=3O2��g������Ӧ�ȡ�H=��-235.8kJ?mol-1����2+��+62.2kJ?mol-1��
��3=-285kJ/mol��
�����������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в�������缫��ӦʽΪ3H2O-6e-=O3��+6H+�����������������õ������ɹ������⣬��缫��ӦʽΪ3O2+6H++6e-=3H2O2��
��2������10 min��20 min��ʱ����ڣ�CO2��Ũ������0.09mol/L,������CO2��ʾ�ķ�Ӧ����Ϊ0.09mol/L/10min=0.009/mol/��L.min����
�ڷ�Ӧ���е�20minʱ��ƽ��״̬����ʱNO��N2��CO2��ƽ��Ũ�ȷֱ���0.4mol/L��0.3mol/L��
0.3mol/L������ƽ�ⳣ��K=0.32mol/L/0.42mol/L=0.5625��
��A���÷�Ӧ�Ƿ�Ӧǰ������ѹǿ����ķ�Ӧ������ѹǿ���䲻���жϷ�Ӧ�Ƿ��ƽ��״̬������B��ƽ��ʱ��v��(NO)=2v��(N2)������C����Ӧ��ʼʱ������̼���������һֱ����ƽ��״̬ʱ������CO2������������䣬��ȷ��D���÷�Ӧ�й�����룬�������������һֱ��������������䣬����������ܶ�һֱ�ڱ䣬����ƽ��ʱ�������ܶȲ��ٱ仯����ȷ����ѡCD��
�ܴӱ������ݿ�֪��40minʱNO��Ũ�ȼ�С��������Ũ����������̼��Ũ�ȼ�С�������ж�ƽ�������ƶ����ı�������Ǽ�С������̼��Ũ�ȣ�ʹƽ�������ƶ���
�ݸ÷�Ӧ�Ƿ�Ӧǰ����������ʵ�������ķ�Ӧ���ı�NO��Ũ�ȴﵽ��ƽ���ǵ�Чƽ�⣬����NO��ת���ʲ��䡣
���㣺�����˹���ɵ�Ӧ�ã��绯ѧԭ����Ӧ�ã���ѧƽ�����۵�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
��1��������ȼ������ʱ����Ӧ��N2(g)+O2(g)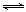 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T ��ʱ����5L�ܱ������г���8mol N2��9molO2��5min���ƽ��ʱNO���ʵ���Ϊ6mol������������µ�ƽ�ⳣ����д��������̣���
2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T ��ʱ����5L�ܱ������г���8mol N2��9molO2��5min���ƽ��ʱNO���ʵ���Ϊ6mol������������µ�ƽ�ⳣ����д��������̣���
��2��H2��CO���Դ���ԭNO�Դﵽ������Ⱦ��Ŀ�ģ�
����֪��N2(g)+ O2(g) = 2NO(g) ��H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l) ��H = -571.6kJ/mol
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽΪ ��
�ڵ�����һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ�Ƿ�Ӧ��2NO(g) + 2CO(g) 2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ����ͼ�л���NO��Ũ����T1��S2 �����´ﵽƽ������еı仯���ߣ���ע��������
2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ����ͼ�л���NO��Ũ����T1��S2 �����´ﵽƽ������еı仯���ߣ���ע��������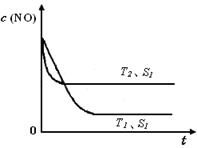
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ�Ҳ����NH3������Ҳ����CH4����ԭNOx�������������������Ⱦ�����磺
CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g) ��H����574 kJ��mol��1
CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g) ��H����1160 kJ��mol��1
���ñ�״����2��24L CH4��ԭNO2��N2����������ת�Ƶĵ�������Ϊ______�������ӵ�������ֵ��NA��ʾ�����ų�������Ϊ______kJ��
��2����֪��2SO2(g)+O2(g) 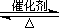 2SO3(g) ?H=-196��6 kJ��mol-1
2SO3(g) ?H=-196��6 kJ��mol-1
2NO(g)+O2(g) 2NO2(g) ?H=-113��0 kJ��mol-1
2NO2(g) ?H=-113��0 kJ��mol-1
��������ӦNO2(g)+SO2 (g) SO3(g)+NO(g)��?H= kJ��mol-1��
SO3(g)+NO(g)��?H= kJ��mol-1��
������һ�������£���NO2��SO2�������1:2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
A��ÿ����1 mol SO3��ͬʱ����1 mol NO2 B����ϵѹǿ���ֲ���
C�����������ɫ���ֲ��� D�� SO3��NO������ȱ��ֲ���
������ij�¶��£�SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ����ͼ������ʾ��
ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A)_______K(B)���������������������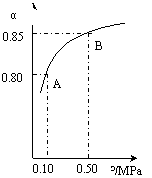
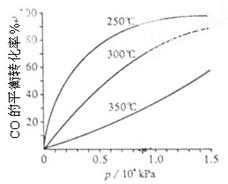
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g) CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ���ң���ʾ���÷�Ӧ?H 0���>���� <������
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ���ң���ʾ���÷�Ӧ?H 0���>���� <������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��20����30�����Eyring��Pzer����ײ���۵Ļ����������ѧ��Ӧ�Ĺ���̬���ۣ���ѧ��Ӧ������ͨ������ײ������ɵģ������ڷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ����ʾ��NO2��CO��Ӧ����CO2��NO�����е������仯ʾ��ͼ��˵�������Ӧ�� ������ȡ����ȡ�����Ӧ��NO2��CO�������� ���������������������CO2��NO����������

��ij�¶�ʱ����һ��2 L���ܱ������У�X��Y��Z�����������ʵ�����ʱ��ı仯������ͼ����ʾ������ͼ�����ݣ�����д���пհף�
�ٸ÷�Ӧ�� minʱ�ﵽƽ��״̬����Ӧ�ȣ���
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣���֪��NaAlO2�Ʊ�����Al(OH)3������ת����ϵ��ͼ��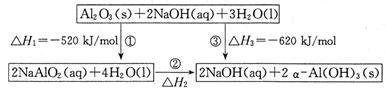
��1����Ӧ�ڵ��Ȼ�ѧ����ʽΪ ��
��2��������������ת����ϵ���ݶ���˾�ҵ���һ�ּ�ݵĴ��������ȡAl2O3�ķ������������£�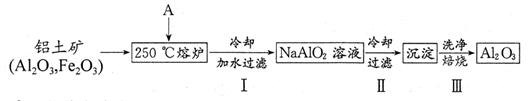
������A�Ļ�ѧʽΪ ��
�ڲ����Ļ�ѧ��Ӧ����ʽΪ �����鲽����г����Ƿ�ϴ���ķ����� ��
�۲���������ȴ�ķ�����������Al(OH)3���ô�ʩ�������� ��
�ܹ�ҵ�Ͽɵ����������Al2O3�Ի��Al�������2.7kgAl��������������A�����ʵ�������Ϊ mol���������������Na[AlCl4]��NaCl�Ļ�������Al2O3���е����Al����������ӦΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��16�֣����ȫ�����س���������������������Ҫ��Ⱦ���ǿ����������PM2.5�͵������������(PM2.5ֱ���ӽ�2.5��10-6m��1����=10-9m)����Ҫ��ԴΪ��ҵ������������β���ȡ���˶�PM2.5��SO2��NOx�����о������������ش�
(1) ���й���PM2.5˵����ȷ����
a.PM2.5�ڿ������γ��˽��壻
b.PM2.5������������������ж����к����ʣ�
c.�ٿ�˽�ҳ�������ѡ�����������У�ij�̶ֳȿ��Լ���PM2.5��Ⱦ
(2) ȡPM2.5����������ˮ�����Ƶ�����������ø���������ˮ���������Ӽ���ƽ��
Ũ�����±�
| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ��/ mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
 2NO(g) ��H=+180.5kJ��mol-1
2NO(g) ��H=+180.5kJ��mol-1  2CO(g) ��H ="-" 221.0 kJ��mol-1
2CO(g) ��H ="-" 221.0 kJ��mol-1 CO2( g) ��H ="-" 393.5 kJ��mol-1
CO2( g) ��H ="-" 393.5 kJ��mol-1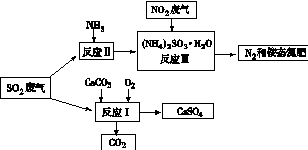
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�������γɶ��ֻ������NH3��N2H4��HCN��NH4NO3�ȡ�
��1����֪��N2(g)+2H2(g)=N2H4(l) ��H=" +" 50.6kJ��mol-1
2H2(g)+O2(g)=2H2O(l) ��H="-571.6" kJ��mol-1
���N2H4(l)+O2(g)=N2(g)+2H2O(l) ��H= kJ��mol-1
��N2(g)+2H2(g)=N2H4(l) �����Է����е�ԭ���� ��
���ô������������������Եõ�N2H4��ϡ��Һ���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2���ɿ��Һ�е�CN-����H2O2��������֪��H2SO4=H++ HSO4- HSO4-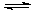 H++ SO42-
H++ SO42-
�ò��缫������������Һ��������������S2O82-��S2O82-ˮ����Եõ�H2O2��д�������ϵĵ缫��Ӧʽ ��
��3������þ������ �ķ�ˮ�ᷢ�����·�Ӧ��
�ķ�ˮ�ᷢ�����·�Ӧ��
MgO+H2O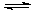 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2+ +2NH3��H2O��
Mg2+ +2NH3��H2O��
���¶ȶԵ������ʵ�Ӱ����ͼ��ʾ����25��ǰ�������¶ȵ�ȥ���������ԭ���� ��
��ʣ�������þ������Է�ˮ�γɶ�����Ⱦ�������� ��
��4���ζ������ˮ�еİ������������������백�������ʽ������ˮ�У��������£���ȡ10 mL��ˮˮ����������ƿ�У��ټ�����ˮ�������Ϊ175 mL���Ƚ�ˮ���������ԣ��ټ�������þʹˮ�������ԣ����Ȣ���25 mL��������������İ�[2NH3+4H3BO3��(NH4)2B4O7+5H2O]�ܽ�����Һ������ƿ�У�����2��ָʾ������c mol��L-1������ζ����յ�[(NH4)2B4O7+H2SO4+5H2O��(NH4)2SO4+4H3BO3]����¼���ĵ����V mL����ˮ���е��ĺ����� mg��L-1���ú�c��V�ı���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��Դ��ȱ���������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϡ�
��1����֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) ��H= ��1275.6 kJ��mol��1
��H2O(l) H2O(g) ��H="+" 44.0 kJ.mo��1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ ��
��2����ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g) CH3OH(g)��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯ͼ��
CH3OH(g)��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯ͼ��
���ڡ�ͼ1���У����� ���a����b������ʾʹ���˴�����
�����жϸ÷�Ӧ�ڡ�ͼ2�������������Ƿ��Ѵﻯѧƽ��״̬�������� ����˫ѡ��
| A��������ѹǿ���� | B����ϵ���ܶȲ���ʱ��ı� |
| C��v��(H2)=2v��(CH3OH) | D��CO��H2�����ʵ����ıȲ���ʱ��ı� |
 CH3OH(g)�Ļ�ѧƽ�ⳣ��K= ��
CH3OH(g)�Ļ�ѧƽ�ⳣ��K= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
100 mL 6 mol��L-1��H2SO4��Һ������п�۷�Ӧ,��һ���¶���,Ϊ�˼�����Ӧ���е�����,���ֲ�Ӱ����������������,����Ӧ���м���������(�� )
��Na2CO3��Һ����ˮ����K2SO4��Һ����KNO3��Һ
| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com