





 +O2
+O2| Cu |
| △ |
 +2H2O
+2H2O +O2
+O2| Cu |
| △ |
 +2H2O
+2H2O| 反应物 |
| 反应条件 |
| ||
| 反应条件 |
| ||
| 反应条件 |


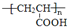 ,由此可知E应为CH3CH(OH)COOH,被氧化生成M,M为
,由此可知E应为CH3CH(OH)COOH,被氧化生成M,M为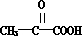 ,不能发生银镜反应,B应为CH3CH(OH)COONa,说明A在碱性条件下生成CH3CH(OH)COONa、NaCl和C,D为氯化钠,G为AgCl,C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C为
,不能发生银镜反应,B应为CH3CH(OH)COONa,说明A在碱性条件下生成CH3CH(OH)COONa、NaCl和C,D为氯化钠,G为AgCl,C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C为 ,F为
,F为 ,所以有机物A为
,所以有机物A为 或
或 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.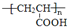 ,由此可知E应为CH3CH(OH)COOH,被氧化生成M,M为
,由此可知E应为CH3CH(OH)COOH,被氧化生成M,M为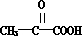 ,不能发生银镜反应,B应为CH3CH(OH)COONa,说明A在碱性条件下生成CH3CH(OH)COONa、NaCl和C,D为氯化钠,G为AgCl,C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C为
,不能发生银镜反应,B应为CH3CH(OH)COONa,说明A在碱性条件下生成CH3CH(OH)COONa、NaCl和C,D为氯化钠,G为AgCl,C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C为 ,F为
,F为 ,所以有机物A为
,所以有机物A为 或
或 ,
, 或
或 ,
, 或
或 ;
;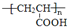 ,
, 氧化为
氧化为 ,反应方程式为:
,反应方程式为: +O2
+O2| Cu |
| △ |
 +2H2O,
+2H2O, +O2
+O2| Cu |
| △ |
 +2H2O;
+2H2O; ,
, .
.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(2008?揭阳一模)表中是食用碘盐包装上的部分说明,下列说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | Mn | Fe | |
| 电离能( kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com