



| 各个生成物平衡浓度的系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
| c(CO2)8 |
| c(O2)7 |
| c(CO2)8 |
| c(O2)7 |
| ||
| ||


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:不详 题型:填空题
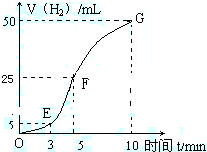
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.纯锌与稀硫酸反应 |
| B.纯锌与浓硫酸反应 |
| C.含铜、铅等杂质的粗锌与稀硫酸反应 |
| D.粗锌与稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源:杭州一模 题型:单选题
| A.pH越小氧化率越大 |
| B.温度越高氧化率越大 |
| C.Fe2+的氧化率仅与溶液的pH和温度有关 |
| D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入少量NaOH固体 | B.加入少量CH3COONa固体 |
| C.加入少量NH4Cl固体 | D.加入少量Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.活化分子的能量明显增加 |
| B.降低了反应的活化能 |
| C.增加了活化分子的百分数 |
| D.改变了化学反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com