
【题目】原电池的负极发生()反应,电解池的阳极发生()反应
A. 氧化 氧化 B. 还原 还原 C. 氧化 还原 D. 还原 氧化
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
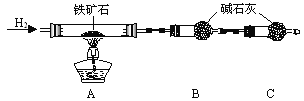
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)若将H2换成CO,则还需补充 装置。
(3)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
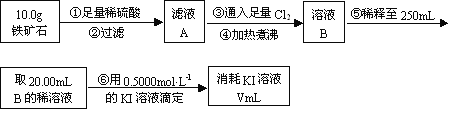
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(4)若滴定过程中消耗0.5000mol·L1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒沙特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.在合成氨的反应中,加压有利于氨的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。
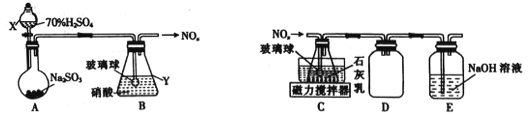
①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨是一种很好的溶剂,在许多性质方面同水相似,一定条件下金属钠和液氨反应得到NaNH2, NaNH2和N2O反应可以制备化合物甲, 同时还有两种碱性物质生成。取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。请回答:
(1)写岀N2的电子式 。
(2)Na与NH3反应的化学方程式 。
(3)Na和液氨反应还可能生成Na2NH、Na3N,说明理由 。
(4)NaNH2和N2O反应制备甲的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H+、NO3-、Fe2+、Na+ B.Ag+、K+、I-、Cl-
C.K+、Ba2+、OH-、SO42- D.K+、Cu2+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活及环境密切相关,下列有关说法正确的是
A. 酸雨的pH在5.67.0之间
B. Al(OH)3可用于治疗胃酸过多
C. 用于光缆通信的光导纤维和制作航天服的聚酯纤维都是新型无机非金属材料
D. 用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分:
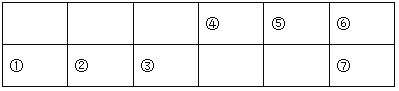
已知:⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝。
用化学式或元素符号回答下列问题:
(1) ④在周期表中的位置_______。
(2) ①②③中,最高价氧化物对应的水化物碱性最强的物质的电子式为_________。
(3) ①②⑥的简单离子半径由大到小的顺序是___________。(填离子符号)
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:____________。
(5) ①和⑥形成的一种化合物A中含有一种10电子微粒和一种18电子微粒,则A中含有的化学键类型为______。
(6) ⑥、⑦分别形成的氢化物沸点高的是_______(填化学式)。原因是_______。
(7) ①、③分别形成的最高价氧化物对应的水化物相互反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com