
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
FeOCr2O3 + Na2CO3 + ![]() Na2CrO4 + Fe2O3 + CO2↑;
Na2CrO4 + Fe2O3 + CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑。
(2)固体A中主要含有 (填写化学式)。
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28[来 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
①该反应能发生的理由是 。
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、 、 、过滤、洗涤、干燥得到晶体。
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为______ (用含m、n的代数式表示)。
【答案】
(1)4 8 7O2 8 2 8;(2)Fe2O3、MgO
(3)由于存在反应平衡2CrO42-+2H+![]() Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-。
Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-。
(4)①温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾;②加热蒸发;冷却结晶。
(5)氢氧化钠溶液;![]() 。
。
【解析】
试题分析:(1)反应中Fe、Cr元素化合价升高,结合元素守恒可知缺陷物质为氧气,Fe元素化合价由+2价升高为+3价,Cr元素化合价由+3价升高为+6价,总升高+7价,O元素化合价由0价降低为-2价,共降低4价,化合价升降最小公倍数为28,故FeOCr2O3的系数为4,氧气系数为7,再根据原子守恒配平后方程式为:4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,故答案为:4;8;7O2;8;2;8;
8Na2CrO4+2Fe2O3+8CO2,故答案为:4;8;7O2;8;2;8;
(2)焙烧时MgO未反应,焙烧后的固体加水浸取,分离得到固体A为Fe2O3、MgO,故答案为:Fe2O3、MgO;
(3)由于存在反应平衡Cr2O72-+H2O![]() 2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:由于存在反应平衡2CrO42-+2H+
2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:由于存在反应平衡2CrO42-+2H+![]() Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-;
Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-;
(4)①温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,低温下四种物质中K2Cr2O7的溶解度最小,利用复分解反应在低温下可以得到重铬酸钾,故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,低温下四种物质中K2Cr2O7的溶解度最小,利用复分解反应在低温下可以得到重铬酸钾;
②加入KCl固体后,利用溶解度不同,温度对溶解度影响,再经过加热浓缩、冷却结晶、过滤、洗涤、干燥可以得到K2Cr2O7晶体,故答案为:加热浓缩、冷却结晶;
(5)固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,为精确分析B中氢氧化铝含量,先利用氢氧化铝的两性,用过量的氢氧化钠溶液溶解氢氧化铝,过滤除去不溶物,向滤液中通入二氧化碳重新生成氢氧化铝沉淀,灼烧得到氧化铝固体,根据Al元素守恒,样品中氢氧化铝的质量分数=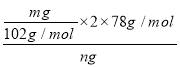 =
=![]() ,故答案为:NaOH溶液;
,故答案为:NaOH溶液;![]() 。
。


科目:高中化学 来源: 题型:
【题目】2011年11月,“神舟八号”在酒泉发射升空,并取得圆满成功。“神舟八号”的运载火箭所用燃料是偏二甲肼(C2H8N2)(其中N的化合价为-3)和四氧化二氮(N2O4)。在火箭升空过程 中,燃料发生反应: C2H8N2+ 2N2O4=2CO2+3N2+4H2O提供能量。下列有关叙述正确的是( )
A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B.该反应中N2O4是氧化剂,偏二甲肼是还原剂
C.N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
D.每有0.6 mol N2生成,转移电子数目为2.4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,化学键类型完全相同的是( )
A. SiO2和H2O B. SO2和Na2O2 C. NaCl和HCl D. AlCl3和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素是构成生命的基础物质.在鸡蛋、蔬菜、大米等食物中,富含维生素的是 .“84消毒液”在日常生活中被广泛使用.该消毒液无色,对某些有色物质具有漂白作用,它的有效成分是 (填“KMnO4”或“NaClO“).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开) 1mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能: P-P 198 kJ.mol-1、P-O 360 kJ.mol-1、氧气分子内氧原子间的键能为498 kJ.mol-1 。则P4+3O2 =P4O6的反应热H为
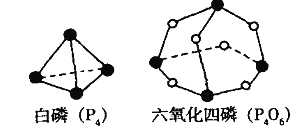
A.+1638 kJ.mol-1 B.-1638 kJ.mol-1
C.-126 kJ.mol-1 D.+126 kJ.mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的说法正确的是( )
A.C5H12属于烷烃且有2种同分异构体
B.乙烯、氯乙烯、甲苯分子中的所有原子均共平面
C.C4H10与Cl2在光照条件下反应,可生成4种一氯代烃
D.苯分子中不含碳碳双键,所以不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(27分)
(1)甲烷和氯气发生的一系列反应都是 ______反应,写出第一步反应的化学方程式 ____________________________________________。
(2)分子中含有34个氢原子的烷烃是 ______(填名称),乙烯的结构简式为_____________________,糖尿病患者尿液中含的糖类的分子式 。
(3)现有四种试剂:A.新制的Cu(OH)2;B.浓硝酸;C.AgNO3溶液;D.碘水。为了鉴别下列四瓶无色溶液,请你选择合适的试剂,将其填入相应的括号中。
①葡萄糖溶液( ) ②食盐溶液( )
③淀粉溶液( ) ④鸡蛋清溶液( )
(4)将下列各组金属与其对应的最佳冶炼方法用线连起来:
金属组 冶炼方法
Fe、Zn、Cu等中等活泼的金属 利用铝热反应原理用Al还原
Na、Mg、Al等活泼金属 以C、CO或 H2 作还原剂还原
Hg、Ag等不活泼金属 电解法
V、Cr、Mn、W等高熔点金属 热分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和PCl3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)已知某有机物的结构简式为: 
(1)该有机物中所含官能团的名称是 。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为______________。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):
______________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com