
【题目】下列各组物质中,化学键类型完全相同的是( )
A. SiO2和H2O B. SO2和Na2O2 C. NaCl和HCl D. AlCl3和KCl
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为()
①加人少量氯水 ②加人少量KMnO4溶液 ③加人少量KSCN溶液
A.①③ B.③② C.③① D.②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300mL 2.0mol·L-1盐酸中加入几小块大理石,产生气体的体积随时间的变化曲线如右图所示(气体体积均在标准状况下测定)试回答下列问题:
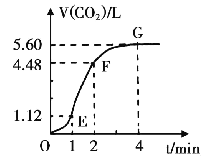
(1)若以反应中消耗的HCl表示反应速率,设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速度为v3,则v1v2v3从大到小的顺序为 ,其中造成v1和v2大小关系的主要原因是
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填编号)
A.蒸馏水 B.Na2CO3 C.氯化钠溶液 D.浓盐酸
(3)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率v(HCl)= ______mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室里对Fe3+与I﹣的反应进行探究,实现Fe3+与Fe2+相互转化.
(1)甲同学首先进行了如下实验:
编号 | 操作 | 现象 |
Ⅰ | 先向2mL0.1molL﹣1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | ___________________ ___________________ |
Ⅱ | 先向2mL0.1molL﹣1FeCl3溶液中滴加KSCN溶液,再滴加0.1molL﹣1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1molL﹣1KI溶液后,血红色无明显变化 |
实验Ⅰ中发生反应的离子方程式为 , .
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
编号 | 操作 | 现象 |
Ⅲ | 向2mL0.1molL﹣1KI溶液中滴加1mL 0.1molL﹣1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I﹣发生氧化还原反应.请结合实验现象说明得出该结论的理由: .
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
编号 | 操作 | 预期现象及结论 |
Ⅳ | 向2mL0.1molL﹣1KI溶液中滴加1mL 0.1molL﹣1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加 , 试管②中滴加 . | 预期现象① , ② . 结论 . |
(4)上述实验结果表明,Fe3+有可能与I﹣发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I﹣物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I﹣反应的离子方程式应写为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F之间存在如图的转化关系(部分物质及反应条件已略去),A.是一种气体肥料,D中含有人体中含量最高的金属元素。
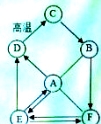
(1)请写出相关的化学式及化学方程式:
A D
C→B
E→F
(2)图示转化关系中未涉及到的基本反应类型是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做完实验后,采用以下方法分别清洗所用仪器,其中清洗方法不合理的是( )
A. 用酒精清洗做过碘升华的烧杯
B. 用水清洗做过银镜反应的试管
C. 用浓盐酸清洗做过高锰酸钾分解实验的试管
D. 用氢氧化钠溶液清洗盛过苯酚的试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
FeOCr2O3 + Na2CO3 + ![]() Na2CrO4 + Fe2O3 + CO2↑;
Na2CrO4 + Fe2O3 + CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑。
(2)固体A中主要含有 (填写化学式)。
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28[来 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
①该反应能发生的理由是 。
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、 、 、过滤、洗涤、干燥得到晶体。
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为______ (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A.钠与水反应:Na+H2O=Na++OH﹣+H2↑
B.硫酸与氢氧化钡溶液反应:H++OH﹣=H2O
C.铁与硫酸铁反应:Fe+Fe3+=2Fe2+
D.氯化钠溶液与硝酸银溶液反应:Ag++Cl﹣=AgCl↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com