
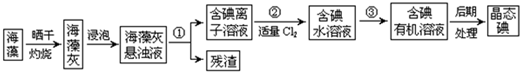
�Ӻ�þ�����κ�ˮ���������õ��IJ����к���±ʯ(xKCl��yMgCl2��zH2O)�����ڿ����м��׳��⡢������ˮ��������طʺ���ȡ����þ����Ҫԭ�ϣ�����ɿ�ͨ������ʵ��ⶨ����ȷ��ȡ5. 550g��Ʒ����ˮ�����l00mL��Һ���ڽ���Һ�ֳɶ��ȷݣ���һ���м���������NaOH��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����0. 580g��������һ����Һ�м��������������ữ��AgNO3��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����4.305g��
��1��������м����ɫ������ϴ���ķ����� ��
��2����֪ij�¶���Mg( OH)2��Ksp =6.4 xl0��12������Һ��c(Mg2+)��1.0��10 ��5mol��L��1����Ϊ������ȫ����Ӧ������Һ��c��OH������ mol��L��1��
��3��ͨ������ȷ����Ʒ����ɣ�д��������̣���
��1��ȡ���һ��ϴ��Һ���������������ữ����������Һ���������ֳ�������ϴ�Ӹɾ���
��2��8��l0��4��3��KCl��MgCl2��6H2O
��������
�����������1������ؼ����ǡ����һ�Ρ�ϴ��Һ�����롰�����ữ����������Һ���������۲���ȱ�٣�
��2��Ksp= c(Mg2+) ��c2(OH��)= 1.0��10��5��c2(OH��)= 6.4 ��l0��12 c(OH��)=8��l0��4mol/L������Һ��
c(OH��) ��8��l0��4mol/L��������ΪMg2+�ѳ�����ȫ��
��3���ɲ���ڵã�m(Mg (OH) 2)= 0. 580g��n(Mg (OH) 2)= 0. 580��58=0.01mol
�ɲ���۵ã�m(AgCl)= 4.305g��n(AgCl)= 4.305��143.5=0.03mol
n(MgCl2)=0.01mol n(KCl) =0.03-0.01��2=0.01mol
n(H2O)=(5.550/2-0.01��95-0.01��74.5)��18=0.06mol
x��y��z=0.01��0.01��0.06=1��1��6
��Ʒ�Ļ�ѧʽΪKCl��MgCl2��6H2O
���㣺���鹤ҵ�ⶨ��������е��й�ʵ���������������ݡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ���и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
�Ӻ�þ�����κ�ˮ���������õ������к���±ʯ(xKCl��yMgCl2��zH2O)����������طʺ���ȡ����þ����Ҫԭ�ϣ�����ɿ�ͨ������ʵ��ⶨ��
��ȷ��ȡ5.550g��Ʒ����ˮ�����100.0mL��Һ��
�ڽ���Һ�ֳɶ��ȷݣ���һ���м���������NaOH��Һ��������ȫ�����ˡ�ϴ�ӡ���
�������أ��õ���ɫ����0.580g��
������һ����Һ�м��������������ữ��AgNO3��Һ��������ȫ�����ˡ�ϴ�ӡ�����
�����أ��õ���ɫ����4.305g��
��1��������м����ɫ������ϴ���ķ����ǣ� ��
��2����֪ij�¶���Mg(OH)2��Ksp��6.4��l0−12������Һ��c(Mg2+)��1.0��10−5mol��L−1����Ϊ������ȫ������¶���Ӧ������Һ��c(OH��)�� mol��L−1��
��3��ͨ������ȷ����Ʒ����ɣ�д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ӻ�þ�����κ�ˮ���������õ��IJ����к���±ʯ(xKCl��yMgCl2��zH2O)�����ڿ����м��׳��⡢������ˮ��������طʺ���ȡ����þ����Ҫԭ�ϣ�����ɿ�ͨ������ʵ��ⶨ��
��ȷ��ȡ5. 550g��Ʒ����ˮ�����l00mL��Һ��
�ڽ���Һ�ֳɶ��ȷݣ���һ���м���������NaOH��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����0. 580g��
������һ����Һ�м��������������ữ��AgNO3��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����4.305g��
��1��������м����ɫ������ϴ���ķ����� �� ��
��2����֪ij�¶���Mg(OH)2��Ksp =6.4 ��l0��12������Һ��c(Mg2+)��1.0��10 ��5mol��L��1����Ϊ������ȫ����Ӧ������Һ��c��OH������ �� mol��L��1��
��3��ͨ������ȷ����Ʒ����ɣ�д��������̣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com