
【题目】已知C(s,石墨)=C(s,金刚石) H>0,下列判断正确的是( )
A.此反应为放热反应
B.断裂1mol石墨的化学键需要吸收的能量小于生成1mol金刚石化学键所放出的能量
C.石墨比金刚石稳定
D.此变化为物理变化
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是反应物总能量低于生成物总能量的是
A.铝与稀盐酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
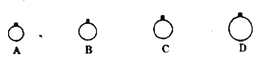
A.气球B中装的是O2
B.气球A和气球C中气体分子数相等
C.气球A和气球D中气体物质的量之比为4:1
D.气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的5种短周期元素。A是最轻的金属,B的最低负化合价的绝对值比最高正化合价少2,C的简单阴离子C2-与氖原子有相同的电子层结构,D与A同主族,E的M层电子数比L层少2个。
(1)写出元素符号:A______、C______,E在元素周期表中的位置是________________;
(2)C、D、E原子半径由大到小:______(写元素符号,后同),C、D、E简单离子的半径由大到小_____;
(3)A常用作电池的电极材料,含A的电池通常采用非水电解质或固体电解质,原因是______(用化学方程式解释);
(4)B与氢元素可以形成10电子微粒X和18电子微粒Y,Y是一种良好的火箭燃料。X中含有的共价键类型是_______,Y的电子式为_________;
(5)C的两种单质在常温下都是气体,它们互为____________。比较C的氢化物和E的氢化物沸点:C___E(填“>”“<”或“=”),原因是____________
(6)用电子式表示D与E的二元化合物的形成过程:________________,碳原子与E能形成AB2型化合物,请写出该物质的电子式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如下图所示(部分夹持装置省略)。
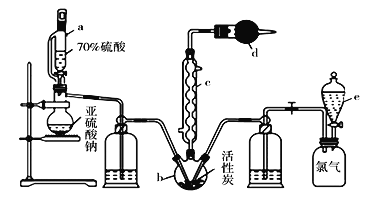
已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。现拟用干燥的Cl2和SO2在活性炭催化下制取磺酰氯:Cl2(g)+SO2(g)![]() SO2Cl2(l),实验装置如图所示。
SO2Cl2(l),实验装置如图所示。
(1)化合物SO2Cl2中S元素的化合价为__________。
(2)仪器c的名称是_________,c中通入冷水的作用是___________
(3)由仪器c的使用可知SO2与Cl2的反应ΔH____0(填“<”或“>”),仪器d 的作用是____。
(4)采用上述部分装置获得干燥的原料气Cl2与SO2。装置e中所盛放的溶液为______(填溶液的名称)。
(5)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为_______。
(6)反应结束后,将仪器b里的混合物分离的方法是______,
若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为___(保留三位有效数字)。
(7)为提高本实验中磺酰氯的产率,在实验操作中需要注意的事项有_____(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈瓶发烫,可适当降温 ④加热三颈瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物分子的空间结构为正四面体,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为 23:16.含Y元素的可溶性化合物E和含X的可溶性化合物F,在10mL 1.0molL﹣1 E 溶液中滴加1.0molL﹣1 F溶液,产生沉淀的物质的量(n)与F溶液体积(V)的关系如图所示。下列说法一定正确的是( )
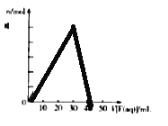
A. 原子半径:X>Y>R
B. 最高价氧化物对应水化物的酸性:Z>Y>R
C. X和Y的单质组成的混合物不能完全溶于水
D. 工业上,通过电解熔融氯化物制备Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
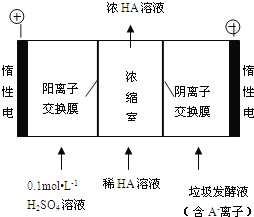
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体中含有极性共价键,关于该晶体说法错误的是( )
A.不可能是离子晶体
B.不可能是单质分子构成的晶体
C.可能是分子晶体
D.可能具有较高的熔沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com